Анемия хронических заболеваний
Определение
Анемия хронических заболеваний (АХЗ) представляет собой вторичную анемию, возникающую на фоне различных инфекционно-воспалительных, аутоиммунных или опухолевых заболеваний, продолжающихся более 1–2 месяцев. Данный вид анемии также называют «анемией хронического воспаления» или «цитокин-индуцированной анемией». АХЗ по распространенности занимает 2-е место после железодефицитной анемии (ЖДА).
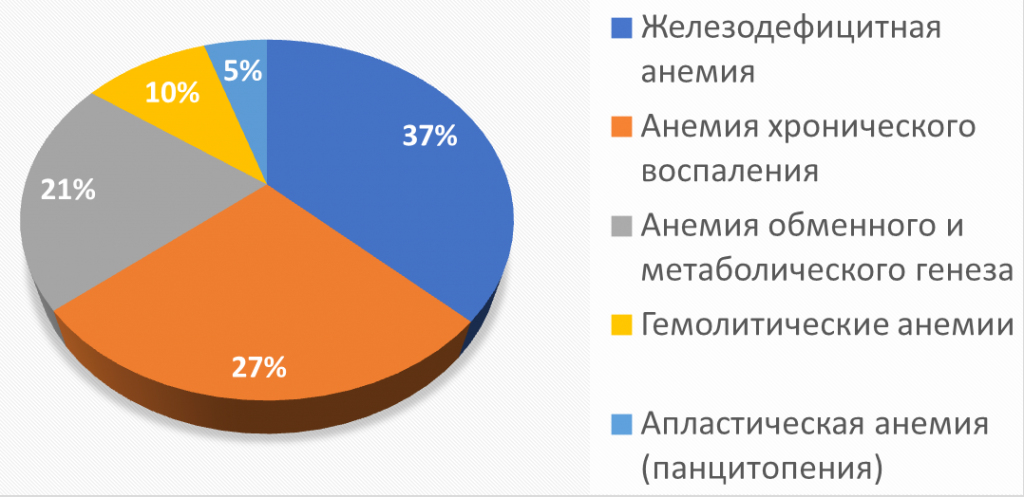
Рисунок 1. Наиболее частые причины анемий в клинической практике (ВОЗ, 2016).
История вопроса
Впервые о сопутствующей анемии при хроническом заболевании упоминается в 1842 г., когда французские исследователи обнаружили у пациентов, заражённых оспой, уменьшение массы эритроцитов. Дальнейшие наблюдения за пациентами с брюшным тифом, туберкулёзом, сифилисом позволили M.Wintrobe и G.Cartwright ввести в 1949 г. термин «анемия воспаления», а в 1952 г. АХЗ стали считать самостоятельной нозологической единицей.
В начале 80-х годов прошлого века E.Weinberg представил теорию, о том, что железо служит необходимым компонентом для поддержания жизненно важных функции всех живых организмов, в том числе бактерий и опухолевых клеток. Исходя из этой теории, можно заключить, что анемия воспалительного ответа – природный защитный механизм, направленный на ограничение свободного железа (Fe3+) в крови при попадании в организм патогенов, что достигается быстрым связыванием железа с лактоферрином, а также путём его депонирования (ферритин). При воспалительных процессах синтез ферритина и лактоферрина повышается, вследствие чего возникает дефицит железа, что способствует снижению роста патогенных микроорганизмов. Гепсидин, играющий принципиальную роль в патогенезе развития АХЗ, является острофазовым белком и блокирует всасывание железа в кишечнике и его высвобождение из депо.
Этиология
Развитие АХЗ отмечается под действием различных этиологических факторов. Наиболее распространенные заболевания, которые сопровождаются АХЗ представлены в табл. 1.
Таблица 1. Основные причины АХЗ
|
Ассоциированное заболевание |
Предполагаемая частота анемии, % |
|---|---|
|
Инфекционные заболевания (острые и хронические):
|
18–95 % |
|
Онкологические заболевания
|
30–77 % |
|
Аутоиммунные заболевания
|
8–71% |
|
Другие неинфекционные хронические заболевания и состояния:
|
8–70% |
|
Хроническая болезнь почек (ХБП) |
23–50% |
АХЗ часто обнаруживается (8–33 % пациентов) на фоне хронических инфекционно-воспалительных и деструктивных заболеваний легких, таких как хроническая обструктивная болезнь легких (ХОБЛ), бронхоэктатическая болезнь, абсцесс, эмпиема плевры, туберкулез. По данным ряда исследований, распространенность анемии среди пациентов с ХОБЛ составляет 7,5–33,0 %.
Анемия довольно часто выявляется у пациентов с сердечно-сосудистыми заболеваниями инфекционного (ревматизм, бактериальный эндокардит) и неинфекционного генеза (ишемическая болезнь сердца, хроническая сердечная недостаточность [ХСН]). У пациентов с признаками ХСН анемия чаще всего связана с дисфункцией почек и снижением секреции эритропоэтина, а также со значительной активацией цитокинов (повышение уровня ФНО-α).
АХЗ часто развивается при диффузных заболеваниях соединительной ткани (системная красная волчанка, склеродермия), ревматоидном артрите, системных васкулитах, саркоидозе, аутоиммунных заболеваниях кишечника (неспецифический язвенный колит, болезнь Крона), болезнях печени (аутоиммунный гепатит, цирроз печени) и щитовидной железы (аутоиммунный тиреоидит, гипотиреоз).
На фоне ревматоидного артрита АХЗ выявляется в 25–64 % случаев. Основную роль в развитии анемии при ревматоидном артрите играет изменение метаболизма железа, неадекватная продукция эритроцитов костным мозгом. Это может быть связано с воздействием различных провоспалительных цитокинов, таких как интерферон-γ, интерлейкины, ФНО-α.
Анемия является частым осложнением хронической болезни почек (ХБП). Общая частота анемии при ХБП составляет 47 %: при I стадии — 26,7 %, при V стадии — 75,5 %. Основными причинами анемии при патологии почек являются недостаточная секреция эритропоэтина и снижение абсорбции железа в желудочно-кишечном тракте, что приводит к нарушению нормального гемопоэза. У пациентов с ХБП и признаками хронической почечной недостаточности анемия чаще всего имеет смешанный характер. При проведении гемодиализа вследствие кровопотери и применения специальных фильтров для гемофильтрации кроме АХЗ также может развиваться дефицит железа.
АХЗ отмечается при ВИЧ-инфекции, причем на ранней стадии заболевания умеренная анемия наблюдается у 15–20 % пациентов и у 75–90 % в случаях, когда ВИЧ-инфекция осложняется другими оппортунистическими инфекциями.
АХЗ часто выявляется у больных с солидными новообразованиями. Так, при раке легкого АХЗ диагностируется у 71 % пациентов, при опухолевых заболеваниях женской репродуктивной системы — у 65 %.
Анемия также отмечается у пациентов с гемобластозами, в частности при острых и хронических лейкозах, миелодиспластическом синдроме (МДС), лимфомах, множественной миеломе. Однако развитие анемии при гемобластозах обусловлено прежде всего инфильтрацией костного мозга опухолевыми клетками, а также проводимой химио- и лучевой терапией, которые оказывают миелосупрессивное воздействие на костный мозг.
Патогенез
Основной механизм развития АХЗ — иммуновоспалительный. Повышенная экспрессия провоспалительных цитокинов является ключевым звеном патогенеза АХЗ. На фоне инфекционных заболеваний, опухолевых процессов, иммунных состояний происходит активация Т-клеток и моноцитов, которые продуцируют в ходе иммунной реакции цитокины, такие как ИФН-γ, ФНО-α, ИЛ-1, ИЛ-6, ИЛ-10.
Патогенетическое воздействие провоспалительных цитокинов при АХЗ разноплановое: нарушение обмена железа, уменьшение образования эритропоэтина и угнетение нормального эритропоэза в костном мозге.
1. Нарушение обмена железа.
Гепсидин – пептидный гормон, синтезируемый печенью и являющийся ключевым регулятором системного гомеостаза железа. Относится к белкам острой фазы, участвует в инфекционных и воспалительных процессах, обеспечивает защиту печени от перегрузки железом. Секретируется в ответ на повышение уровня железа и воспаление. Гепсидин является негативным регулятором поглощения и переработки железа. Он связывается с единственным известным клеточным экспортером железа ферропортином, вызывает его интернализацию и деградацию, тем самым уменьшая отток железа из клеток-мишеней и снижая уровень сывороточного железа. Главный механизм действия гепсидина заключается в блокировании основных процессов восполнения железа – всасывания в двенадцатиперстной кишке и высвобождения накопленного железа из гепатоцитов и макрофагов, в результате чего происходит депонирование железа в этих клетках. Макрофаги играют центральную роль в метаболизме железа и участвуют в повторном использовании железа из стареющих эритроцитов, что обеспечивает более 95% суточной потребности в железе для нормальных физиологических процессов, включая эритропоэз.
Основным индуктором экспрессии гепсидина является ИЛ-6. При хроническом воспалении выработка гепсидина перестает зависеть от уровня железа (в норме при низком уровне железа синтез гепсидина подавляется) и, наоборот, увеличивается за счет стимуляции ИЛ-6.
Отмечена роль ИЛ-1β, который инициирует продукцию лактоферрина, связывающего свободное железо, которое в дальнейшем депонируется в макрофагах. Имеет значение и отрицательное воздействие белков острой фазы, которые могут связывать трансферрин, уменьшая связывание железа с трансферрином предшественниками эритропоэза.
Таким образом, развивается функциональный дефицит железа: оно оказывается недоступным для эритропоэза, несмотря на адекватное или высокое его содержание в организме. Недостаточное поступление железа в костный мозг сопровождается нарушением эритропоэза и, как следствие, снижением показателей красной крови.
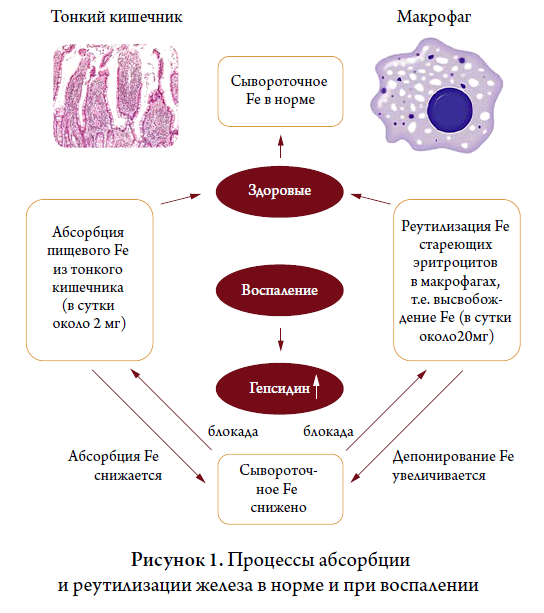
Исследование уровня гепсидина в сыворотке крови может быть использовано в алгоритме дифференциальной диагностики железодефицитной анемии (ЖДА) и функционального дефицита железа при АХЗ (см.ниже).
При ЖДА концентрация гепсидина в сыворотке и моче значительно снижается, часто гепсидин не обнаруживается. Даже в отсутствие анемии гепсидин расценивается как чувствительный индикатор дефицита железа. Кроме того, по сравнению с гематокритом или гемоглобином снижение уровня гепсидина служит ранним маркером дефицита железа вместе с насыщением трансферрином и уменьшением уровня ферритина. Снижение уровня гепсидина ведет к высвобождению накопленного железа и усилению всасывания железа в кишечнике.
У пациентов с сочетанной ЖДА и АХЗ уровень гепсидина обычно ниже, чем у пациентов с изолированной анемией хронических заболеваний.
Повышенный уровень гепсидина отмечается при острофазовом ответе, переизбытке поступающего в организм железа, в том числе приеме препаратов железа, талассемии, гемохроматозе.
2. Угнетение эритропоэза также обусловлено негативным воздействием цитокинов (ИФН-γ/-α, ФНО-α и ИЛ-1) на клетки-предшественники эритропоэза, что приводит к нарушению пролиферации и дифференцировки клеток эритроидного ростка кроветворения.
Одной из причин снижения стимулирующего действия эритропоэтина на эритропоэз является нарушение связывания эритропоэтина с рецептором под влиянием негистонового хромосомного белка HMGB1, высвобождающегося в условиях системного воспалительного ответа.
Эритропоэз у пациентов с АХЗ может также страдать под воздействием самого хронического заболевания, являющегося этиологическим фактором, например в случае инфильтрации клетками опухоли или микроорганизмами костного мозга, что наблюдается, в частности, у пациентов с ВИЧ и малярией.
3. Снижение синтеза эритропоэтина. Важнейший фактор анемии – снижение образования эритропоэтина и уменьшение его биоактивности. Провоспалительные цитокины (ИЛ-6, ФНО-α и др.) угнетают выработку эритропоэтина в почках, что подавляет пролиферацию и созревание эритроидных предшественников в костном мозге, сокращают продолжительность жизни эритроцитов и нарушают регуляцию гомеостаза железа.
4. Снижение продолжительности жизни эритроцитов. У пациентов с АХЗ отмечается снижение продолжительности жизни эритроцитов. Патогенез этого явления не вполне ясен. Наиболее вероятно, причиной является гиперпродукция цитокинов (ИЛ-1), которые повышают способность макрофагов поглощать и разрушать эритроциты.
5. Перегрузка железом органов-депо. Вследствие фагоцитоза эритроцитов в тканевых макрофагах, происходит избыточное накопление железа в виде гемосидерина и ферритина, что приводит к снижению содержания микроэлемента в сыворотке. Развивается перегрузка железом органов-депо, что считается основной особенностью АХЗ.
![Рисунок 2. Патогенез анемии хронических заболеваний [2]. Рисунок 2. Патогенез анемии хронических заболеваний [2].](/upload/medialibrary/f95/dif.diagnoz-AKHZ-i-ZHDA.png)
Рисунок 2. Патогенез анемии хронических заболеваний [2].
Клиническая картина
Клинические проявления АХЗ в основном зависят от заболевания, с которым она связана. В большинстве случаев симптомы основного заболевания превалируют над анемией, но иногда анемический синдром может быть его первой манифестацией. У пациентов с анемией отмечаются клинические признаки гипоксии (слабость, быстрая утомляемость, общее недомогание, снижение концентрации внимания, одышка при незначительной или умеренной нагрузке, сердцебиение, головная боль). При тяжелой анемии или наличии сопутствующих заболеваний возможно развитие сердечной недостаточности. Важный симптом анемии — бледность кожных покровов, видимых слизистых оболочек и ногтевых лож. При объективном обследовании отмечается усиление сердечного толчка и сердечных тонов, появление функционального систолического шума при аускультации сердца.
Лабораторная диагностика и дифференциальный диагноз
Основным диагностическим критерием анемии является стойкое снижение концентрации гемоглобина менее 120 г/л у женщин и менее 130 г/л и мужчин.
При проведении дифференциальной диагностики необходимо уточнять тип дефицита железа (абсолютный — при ЖДА или функциональный — на фоне АХЗ).
1. Рекомендуется выполнение общего (клинического) анализа крови с определением уровня гемоглобина, количества эритроцитов и ретикулоцитов, гематокрита, среднего объёма эритроцита (MCV), среднего содержания гемоглобина в эритроците (MCH), средней концентрации гемоглобина в эритроците (MCHC).
2. Рекомендуется исследование показателей обмена железа: железа сыворотки крови, общей железосвязывающей способности сыворотки (ОЖСС), уровня ферритина в крови, уровня трансферрина сыворотки крови, насыщения трансферрина железом, гепсидина (тест 01.02.15.1670), растворимого рецептора трансферрина (sTfR)(тест 01.02.15.940), отношение sTfR к логарифму ферритина (sTfR/log Fer) (тест 01.02.15.945).
Таблица 1. Дифференциальная диагностика АХЗ, ЖДА и анемии смешанного генеза
|
Показатель |
АХЗ |
ЖДА |
Сочетание АХЗ и ЖДА |
|---|---|---|---|
|
Гемоглобин |
Умеренно снижен |
Снижен |
Снижен |
|
Гипохромия эритроцитов |
Часто |
Всегда |
Возможна |
|
Объем эритроцитов (MCV) |
В норме |
Микроцитоз |
В норме или микроцитоз |
|
Сывороточное железо |
Умеренно снижено |
Снижено |
Снижено |
|
ОЖСС |
Снижена или в норме |
Повышена |
Снижена или нижняя граница нормы |
|
Насыщение трансферрина железом (НТЖ) |
Снижено |
Снижено |
Снижено |
|
Сывороточный ферритин |
В норме или повышен |
Снижен |
В норме |
|
В норме |
Повышен |
В норме или повышен |
|
|
Низкое или в норме (<1) |
Повышено (>2) |
Повышено (>2) |
|
|
Уровень провоспалительных цитокинов в сыворотке |
Повышен |
В норме |
Незначительно повышен |
|
Повышен |
Снижен |
Повышен |
|
|
Уровень эритропоэтина |
В норме или незначительно повышен |
Повышен |
Повышен или в норме |
АХЗ в большинстве случаев носит нормохромный и нормоцитарный характер с низким уровнем ретикулоцитов. При АХЗ показатели сывороточного железа и насыщения трансферрина, как правило, снижены или в норме, а уровень ферритина в сыворотке крови – повышен, ОЖСС в пределах нормы, низкая продукция ЭПО, неадекватная тяжести анемии. Кроме того, при АХЗ наблюдается более выраженная активация иммунной системы (повышение уровня гепсидина, ИЛ-6, ИФН-γ/-α, ФНО-α, sICAM-1 и лактоферрина).
Гепсидин (тест 01.02.15.1670) используется для дифференциальной диагностики абсолютного (ЖДА) и функционального (АХЗ) дефицита железа. При ЖДА уровень гепцидина снижен, при АХЗ – повышен.
Растворимый рецептор трансферрина (sTfR) (тест 01.02.15.940) и индекс растворимый рецептор трансферрина/ферритин (sTfR/log Fer) (тест 01.02.15.945) также используются для дифференциальной диагностики ЖДА и АХЗ. При ЖДА оба показателя повышены. При АХЗ sTfR в норме, sTfR/log Fer снижен
При ЖДА имеет место абсолютный дефицит железа, вследствие чего ферротерапия приводит к положительному клинико-гематологическому ответу (активируется эритропоэз, осстанавливаются показатели красной крови). При АХЗ развивается функциональный (относительный) дефицит железа, поэтому на фоне приема препаратов железа внутрь в течение 4 недель и более должного повышения уровня гемоглобина не отмечается, что требует назначения иной патогенетической терапии.
Определение у пациента этиологии анемии (АХЗ или ЖДА) имеет большое практическое значение, поскольку неправильная трактовка результатов может привести к назначению неэффективной терапии железом, что способно повлечь за собой развитие осложнения в виде перегрузки железом.
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить В12-дефицитную или фолиеводефицитную анемию, рекомендуется определение уровня витамина В12 (цианокобаламина) в крови и исследование уровня фолиевой кислоты в сыворотке крови.
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить гемолитическую анемию, рекомендуется проведение тестов на гемолиз (исследование уровня общего билирубина в крови, исследование уровня свободного (неконъюгированного) и связанного билирубина в крови, определение активности лактатдегидрогеназы в крови, прямой антиглобулиновый тест (прямая пробаКумбса)
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить миелодиспластический синдром или нарушение выработки эритропоэтина почками, рекомендуется исследование уровня эритропоэтина крови.
При наличии анемии необходимо помнить о возможности скрытого кровотечения, в том числе из ЖКТ, выявить которое позволяют тесты на скрытую кровь в кале и/или эндоскопическое исследование.
1) Миронова О.Ю., Панферов А.С. Анемия хронических заболеваний: современное состояние проблемы и перспективы. Терапевтический архив. 2022;94(12):1349–1354
2) Куркина Н.В., Горшенина Е.И., Чегодаева Л.В., Полагимова А.В. Анемия хронических заболеваний. Клиническая онкогематология. 2021;14(3):347–54.
3) Валитова А.Д., Кадырова З.М., Ослопов В.Н., Ослопова Ю.В., Хазова Е.В. Анемия хронических заболеваний: приговор или защитная реакция организма? Казанский медицинский журнал. - 2023. - Т. 104. - №3. - C. 393-401.
4) Будкова А.И., Лапин С.В., Павлович Д., Богданов А.Н., Щербак С.Г. Диагностика дефицита железа при анемии хронического воспаления. Лабораторная служба. 2022;11(1):16–21.
5) Сахин В.Т., Маджанова Е.Р., Крюков Е.В., Казаков С.П., & Рукавицын О.А. (2018). Анемия хронических заболеваний: особенности патогенеза и возможности терапевтической коррекции (обзор литературы и результаты собственных исследований). Онкогематология, 13 (1), 45-53.
6) Анемия при злокачественных новообразованиях. Клинические рекомендации. 2024 г.
7) Анемия при хронической болезни почек. Клинические рекомендации. 2024 г.
8) Poggiali E, Migone De Amicis M, Motta I. Anemia of chronic disease: a unique defect of iron recycling for many different chronic diseases. Eur J Intern Med. 2014 Jan;25(1):12-7. doi: 10.1016/j.ejim.2013.07.011