Первичный билиарный холангит
Определение
Первичный билиарный холангит (ПБХ), ранее известный как первичный билиарный цирроз (ПБЦ) – хроническое, медленно прогрессирующее аутоиммунное заболевание печени неизвестной этиологии, характеризующееся наличием антимитохондриальных антител (АМА) и/или антинуклеарных антител (АНА), разрушением внутрипеченочных желчных протоков с развитием негнойного деструктивного холангита и холестаза, которое при естественном течении заболевания приводит к развитию билиарного цирроза.
Помимо первичного билиарного холангита, в группу аутоиммунных заболеваний печени также входят аутоиммунный гепатит (АИГ), первичный склерозирующий холангит (ПСХ)и перекрестные синдромы.
Эпидемиология
ПБХ считается редким заболеванием, поражающим преимущественно женщин старше 40 лет (на их долю приходится 75-90% всех случаев ПБХ). Однако в последние годы в мире наблюдается существенный рост заболеваемости и распространенности ПБХ, в том числе среди мужчин и лиц молодого возраста. Согласно последним эпидемиологическим исследованиям, соотношение женщин и мужчин с ПБХ составляет 4–6 : 1. Данные нескольких исследований показывают, что во всем мире примерно 1 из 1000 женщин старше 40 лет страдает ПБХ [1]. Распространенность ПБХ в европейской популяции составляет около 1,9–40,2 случая на 100 000 населения в год, а заболеваемость — 0,3–5,8 на 100 000 населения. Достоверных статистических данных по распространенности и заболеваемости ПБХ в РФ в настоящее время нет.
Этиология и патогенез
Считается, что ПБХ – полигенное заболевание, которое развивается под действием различных триггерных факторов у генетически восприимчивых лиц. Пусковым фактором, инициирующим заболевание, считается нарушение выработки бикарбоната билиарными эпителиальными клетками (БЭК, холангиоцитами) мелких желчных протоков, что приводит к повышенному поступлению желчных кислот в холангиоцит (теория «дырявого бикарбонатного зонтика») с последующим повреждением мембранных структур, провоцирующих ускоренное старение и апоптоз БЭК мелких желчных протоков. Накопившиеся в апоптотических холангиоцитах желчные кислоты разрушают клеточные мембранные структуры, в том числе внешнюю и внутреннюю мембраны митохондрий.
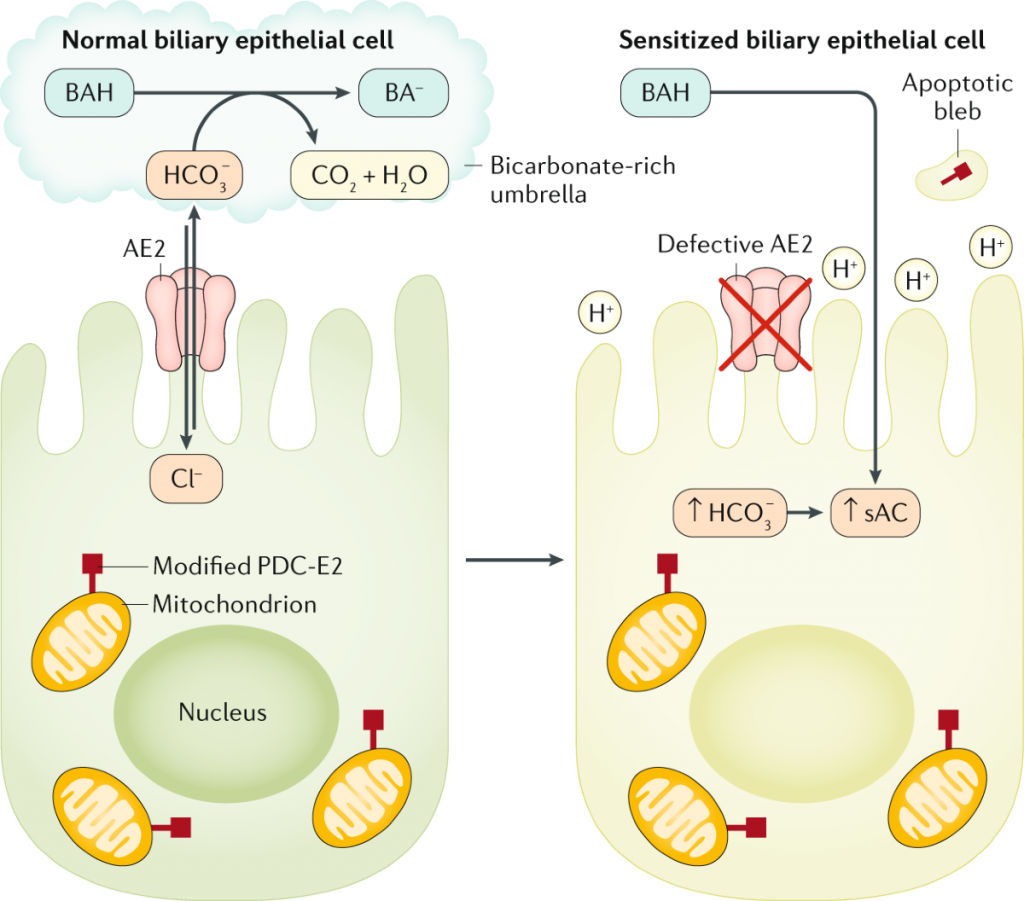
Рис. 1. Нарушение защитного бикарбонатного зонтика над билиарными эпителиальными клетками вследствие дефекта анионного обменника AE2 [8].
Анионный обменник 2-го типа (AE2) является основным Cl–/HCO3–-обменником, экспрессируемым на билиарных эпителиальных клетках (БЭК) и регулирующим внутриклеточный pH и секрецию билиарного HCO3–, что приводит к образованию богатого бикарбонатами «зонтика» на апикальной поверхности холангиоцитов. Этот зонтик защищает БЭК от токсичных гидрофобных желчных кислот (ЖК). Снижение экспрессии AE2 приводит к созданию щелочной внутриклеточной среды, которая распознается растворимой внутриклеточной аденилилциклазой (sAC). Это способствует протонированию солей желчных кислот (BAH) из-за богатого водородом микросреды клеточной поверхности, что делает их более гидрофобными и способными проникать через клеточную мембрану. В результате БЭК становятся чувствительными к апоптозу вследствие воздействия токсичных ЖК. Это приводит к экспонированию модифицированной E2-субъединицы митохондриального комплекса пируватдегидрогеназы (PDC-E2) внутри апоптотических пузырьков, что приводит к изменению иммунологических свойств и индукции выработки аутоантител.
Обладая детергентными свойствами, желчные кислоты взаимодействуют с липоевой кислотой Е2 субъединицы пируватдегидрогеназного комплекса (ПДГ-Е2), которая локализована на внутренней мембране митохондрий, что приводит к изменению иммунологических свойств ПДГ-Е2. Образующийся в результате неоантиген инициирует выработку антимитохондриальных антител (АМА). Развитие апоптоза в мелких БЭК приводит в конечном итоге к развитию дуктулопении - состоянию, при котором происходит значительное уменьшение количества внутрипеченочных желчных протоков, что приводит к нарушению оттока желчи (холестазу). Постепенно прогрессирующий внутрипеченочный холестаз сопровождается повреждением гепатоцитов. В результате происходит нарушение процессов желчевыделения и энтерогепатической циркуляции желчных кислот. Развивающийся внутрипеченочный холестаз приводит к недостаточному поступлению желчных кислот в двенадцатиперстную кишку и повышенному накоплению желчных кислот в гепатоцитах и плазме крови.
Нередко обнаруживаемое у пациентов с ПБХ сочетание с другими аутоиммунными патологиями (синдром Шегрена, склеродермия, аутоиммунный тиреоидит, системная красная волчанка, язвенный колит, болезнь Крона и др.) подтверждает предположение об участии иммунной системы в патогенезе заболевания.
Клинические проявления
Типичный пациент с ПБХ – это женщина среднего возраста с жалобами на кожный зуд и/или выраженную слабость. Другие симптомы включают боль в правом подреберье, похудание, желтуху. Слабость и кожный зуд значительно снижают качество жизни пациентов с ПБХ. Данные симптомы могут быть первыми проявлениями манифестации заболевания, однако, как показывают некоторые наблюдения, их тяжесть не всегда коррелирует с выраженностью патологического процесса в печени.
Интермиттирующий характер зуда может возникать за несколько лет до появления синдрома холестаза. Желтуха является поздним признаком ПБХ и возникает, как правило, через 6 месяцев – 2 года от момента появления кожного зуда. Помимо этого, данный симптом является неблагоприятным прогностическим фактором.
При физикальном обследовании пациента с ПБХ обычно выявляются такие признаки, как гиперпигментация кожных покровов (в результате отложения меланина), их лихенизация, гепатоспленомегалия и ксантелазмы.
Длительно существующий холестаз сопряжен с недостатком желчных кислот, необходимых для полноценного переваривания и всасывания нейтральных жиров, в связи с этим у пациентов с ПБХ может отмечаться диарея с объемным пенистым стулом, приводящая к потере массы тела, несмотря на хороший аппетит и адекватную калорийность пищевого рациона. Нередко клинически значимым у пациентов с ПБХ является нарушение всасывания жирорастворимых витаминов (А, D, Е, К) и кальция. Может наблюдаться остеопороз.
Симптомы и признаки прогрессирующего поражения печени, такие как асцит, кровотечение из варикозно расширенных вен пищевода (ВРВП), а также энцефалопатия обычно встречаются на поздних стадиях ПБХ. Выявление при осмотре телеангиоэктазий, уменьшения мышечной массы проксимальных частей конечностей, асцита, отеков свидетельствует о трансформации заболевания в цирроз печени.
Также ПБХ также может протекать практически бессимптомно, приводя при отсутствии адекватной терапии к развитию печеночно-клеточной недостаточности, тяжелому фиброзу и циррозу печени и смерти.
Таблица 1. Частота встречаемости клинических признаков у пациентов с ПБХ
|
Симптом |
Частота |
|---|---|
|
Слабость |
21–85 % |
|
Кожный зуд |
19–55 % |
|
Гиперпигментация |
25 % |
|
Гепатомегалия |
25 % |
|
Спленомегалия |
15 % |
|
Ксантелазмы |
10 % |
|
Желтуха |
3–10 % |
|
Боль в правом подреберье |
8 % |
|
Бессимптомно |
25–61 % |
По данным многочисленных исследований, пациенты с ПБХ в 32–63% случаев имеют другие аутоиммунные или ревматологические заболевания: синдром Шегрена, аутоиммунный тиреоидит, склеродермия, системная красная волчанка, ревматоидный артрит. Синдром Шегрена — одно из наиболее часто взаимосвязанных с ПБХ аутоиммунных заболеваний, поражает, по данным различных исследований, от 3,5% до 73% пациентов с ПБХ. При синдроме Шегрена у пациентов чаще всего наблюдается сухость глаз, сухость во рту, нарушение вкуса и глотания, гингивит. Патология щитовидной железы выявляется у 5,6–23,6% пациентов с ПБХ. Склеродермия встречается у 1,4–12,3% пациентов с ПБХ. Учитывая склонность ПБХ к ассоциации с другими аутоиммунными заболеваниями, необходимо проводить тщательное обследование таких пациентов с привлечением врачей различных специальностей.
Лабораторная диагностика
Отмечается повышение маркеров холестаза (ЩФ, ГГТП), маркеры цитолиза (АЛТ, АСТ) как правило в номе или незначительно повышены. Отмечается повышение общего холестерина и дислипидемия (из-за нарушения энтерогепатической циркуляции желчных кислот, являющихся «растворителем» холестерина).
Краеугольным камнем в диагностике ПБХ является обнаружение антимитохондриальных антител типа М2 (AMA-M2) и/или специфических для ПБХ антинуклеарных антител (gp210 и Sp100) при наличии признаков холестаза. Специфичность наличия в плазме крови антимитохондриальных аутоантител (АМА) достигает 90-95%.АМА обнаруживаются у пациентов уже в бессимптомной стадии ПБХ, что указывает на их участие в механизме развития заболевания.
У 30–50% пациентов с данным заболеванием также выявляются антинуклеарные антитела (ANA). Наличие специфических для ПБХ ANA — анти-sp100 и анти-gp210 в сочетании с повышенным уровнем ЩФ помогает поставить диагноз у АМА-негативных пациентов. Анти-sp100 и анти-gp210 присутствуют более чем у 30% АМА-негативных больных
Антинуклеарные антитела к gp210 и Sp100 входят в диагностические панели Антитела к антигенам аутоиммунных заболеваний печени и Развернутая серология аутоиммунных заболеваний печени. Данные панели также позволяют проводить дифференциальную диагностику с аутоиммунным гепатитом и диагностику перекрестного синдрома ПБХ/АИГ.
Учитывая высокую специфичность серологических маркеров, биопсия печени не обязательна для подтверждения диагноза ПБХ, но позволяет оценить активность заболевания и стадию фиброза. Биопсия печени выполняется только при отсутствии специфических антител или при подозрении на сопутствующее заболевание печени (аутоиммунный гепатит, неалкогольный стеатогепатит, поражение печени при системных заболеваниях). К гистологическим критериям ПБХ относятся: хронический негнойный деструктивный холангит, повреждение эпителия септальных и междольковых желчных протоков (деструкция, десквамация, дистрофия), образование эпителиоидных гранулем (могут отсутствовать), портальная инфильтрация, пролиферация дуктул, уменьшение количества желчных протоков, появление «пустых» портальных трактов, формирование перидуктулярного фиброза.
Критерии диагностики ПБХ
Согласно рекомендациям Американской ассоциации по изучению болезней печени (AASLD) 2018 г., диагноз ПБХ считается верифицированным при наличии двух из трех диагностических критериев:
1) биохимически подтвержденный холестаз (повышении ЩФ >1,5 раза ВГН),
2) выявление антимитохондриальных антител (АМА-M2) в титре >1:40 или специфичных для ПБХ антинуклеарных антител — анти-sp100 и анти-gp210,
3) морфологические критерии хронического невоспалительного деструктивного холангита
Неклассические формы ПБХ
Помимо классического АМА-позитивного ПБХ существуют и другие формы заболевания:
-
ПБХ с признаками аутоиммунного гепатита (перекрестный синдром ПБХ/АИГ)
-
АМА-М2-негативный ПБХ
-
Изолированная АМА-М2-позитивность
-
ПБХ с признаками первичного склерозирующего холангита (перекрестный синдром ПБХ/ПСХ)
1. ПБХ с признаками аутоиммунного гепатита
Примерно у 5–15% больных ПБХ сразу при постановке диагноза или во время наблюдения (иногда спустя годы после начала заболевания) могут наблюдаться биохимические, серологические и гистологические признаки аутоиммунного гепатита (АИГ).
У пациентов с вариантной формой ПБХ/АИГ чаще встречаются внепеченочные аутоиммунные заболевания, например тиреоидит Хашимото, болезнь Грейвса, витилиго, псориаз, системная красная волчанка.
Наличие вариантного синдрома у пациентов с ПБХ можно заподозрить, если у них наблюдаются следующие признаки: повышение маркеров цитолиза (АЛТ, АСТ), повышение уровня IgG и/или гамма-глобулинов, выявление специфических аутоантител (anti-SMA и/или anti-SLA/LP, anti-LKM и anti-LC1). Типичными гистологическими признаками АИГ являются: портальная и перипортальная инфильтрация лимфоцитами и плазматическими клетками с картиной интерфейс-гепатита (воспалительные инфильтраты, выходящие за перипортальную пластинку), образование печеночных розеток, дольковая некровоспалительная активность, эмпериполез, панлобулярный гепатит и мостовидный некроз.
Следует отметить, что в отдельных случаях начало АИГ по времени не соответствует развитию ПБХ – обычно ПБХ развивается раньше. Тем не менее, в большинстве случаев можно установить одно первичное расстройство (доминирующее заболевание). Обычно это ПБХ.
До сих пор наиболее часто в повседневной клинической практике для диагностики варианта ПБХ/АИГ используются предложенные в 1998 г. Парижские критерии, которые одобрены Европейской ассоциацией по изучению заболеваний печени. Для постановки диагноза ПБХ/АИГ необходимо наличие не менее двух из трех критериев каждого заболевания.
Таблица 2. Парижские критерии диагностики перекрестного синдрома ПБХ/АИГ [2]
|
Заболевание |
Критерии |
|---|---|
|
Первичный билиарный холангит (ПБХ) |
|
|
Аутоиммунный гепатит (АИГ) |
|
|
Необходимо наличие как минимум 2-х из 3-х критериев для каждого заболевания для постановки диагноза перекрестного синдрома ПБХ/АИГ |
|
Данные критерии с высокой чувствительностью (92 %) и специфичностью (97 %) позволяют выявить пациентов с клиническим диагнозом перекрестного синдрома ПБХ/АИГ.
Важно отметить, что Парижские критерии могут не выявлять пациентов с ПБХ/АИГ, у которых имеются менее выраженные лабораторные признаки холестаза. Группа IAIHG подчеркивает, что Парижские критерии не получили независимого подтверждения.
Включенные в Парижские критерии аутоиммунные маркеры (АMА и anti-SMA) могут быть обнаружены при других заболеваниях, включая вирусный гепатит, неалкогольную жировую болезнь печени, болезнь Вильсона, а также ревматоидный артрит и системную красную волчанку. Также стоит отметить, что антитела к растворимому антигену печени/поджелудочной железы (anti-SLA/LP) имеют самую высокую специфичность среди всех аутоантител, связанных с АИГ, хотя они не были включены в Парижские критерии.
Согласно рекомендациям Европейского общества по изучению заболеваний печени и Британского общества гастроэнтерологов, всем пациентам с подозрением на вариантную форму ПБХ/АИГ необходимо выполнять пункционную биопсию печени.
У пациентов, имеющих ПБХ с признаками АИГ, отмечается более тяжелое течение заболевания, а также худшие исходы, чем у лиц, имеющих только ПБХ или только АИГ Отмечается более раннее развитие портальной гипертензии, декомпенсированного цирроза, более частую потребность в трансплантации печени и более высокую смертность.
2. АМА-М2-негативный первичный билиарный холангит
АМА-М2-негативный первичный билиарный холангит – редкая форма заболевания (5% всех случаев ПБХ), при которой в сыворотке крови больных не выявляются антитела к митохондриям, но значительно повышены АНА.
Появление новых, более чувствительных и специфичных методов диагностики ПБХ, таких как метод НРИФ с использованием в качестве субстрата НЕр-2 клеток, твердофазных методов иммунного анализа (ИФА, иммуноблоттинг), повысило чувствительность и специфичность обнаружения АМА и позволило установить, что до 79% пациентов, первоначально считавшихся АМА-отрицательными, на самом деле являлись АМА-положительными.
Большинство проведенных сравнительных исследований АМА-М2-позитивного и АМА-М2-негативного ПБХ показали, что основные клинические проявления, лабораторные данные, морфологические характеристики при обеих формах заболевания преимущественно схожи, хотя некоторые различия и были выделены. У АМА-М2-негативных пациентов менее выражен кожный зуд, чаще наблюдется ассоциация с другими аутоиммунными заболеваниями (синдром Шегрена, ревматоидный артрит, склеродермия). Типичными лабораторными признаками при манифестации заболевания является повышение ЩФ и ГГТП, однако некоторые исследования показали, что у АМА-М2-негативных пациентов уровень холестатических ферментов несколько ниже. При этом также может незначительно повышаться уровень трансаминаз. Согласно современным представлениям, гистологическая картина у АМА-позитивных и АМА-негативных пациентов не имеет принципиальных различий. Частота осложнений - цирроза печени и развития печеночной недостаточности, приводящих к смерти или направлению на трансплантацию печени, существенно не различалась между популяцией АМА-М2-позитивного и АМА-М2-негативного ПБХ.
3. Изолированная АМА-М2-позитивность
Изолированное повышение АМА-М2 при отсутствии синдрома холестаза и клинически значимого заболевания печени, по некоторым данным, встречается у 0,5–0,64% пациентов. В настоящее время нет единого мнения по поводу клинической трактовки выявления АМА-М2 у бессимптомных пациентов. Наряду с точкой зрения о наличии у таких пациентов доклинической стадии ПБХ существует мнение о «здоровом носительстве» антител. При этом известно, что АМА-М2 могут циркулировать в сыворотке крови за месяцы и даже годы до клинико-лабораторной манифестации ПБХ. У некоторых АМА-позитивных пациентов, относящихся к группе риска, несмотря на отсутствие клинических проявлений и холестаза, при гистологическом исследовании ткани печени могут быть выявлены изменения, характерные для ПБХ. Динамический контроль лабораторных показателей необходим при выявлении АМА-М2 у пациентов без других клинико-лабораторных признаков ПБХ, а решение вопроса о проведении биопсии печени представляется оправданным у пациентов, находящихся в группе риска данного заболевания (женский пол, средний возраст, наличие других аутоиммунных заболеваний).
4. ПБХ с признаками первичного склерозирующего холангита (ПБХ/ПСХ)
Данная форма ПБХ встречается исключительно редко, в литературе пока описано менее 10 таких случаев. Этот вариант представляет собой синдром с клиническими и лабораторными признаками как ПБХ, так и ПСХ, включая вариант ПСХ с поражением мелких протоков. В связи с недостаточным количеством данных существование этой формы заболевания все еще является дискутабельным.
Таблица 3. Основные формы ПБХ [2]
|
Форма ПБХ |
Характеристика |
|---|---|
|
Классический (AMA-M2-позитивный) |
|
|
AMA-M2-негативный |
|
|
ПБХ с признаками АИГ |
|
|
AMA-M2-позитивный без холестаза |
|
|
ПБХ с признаками первичного склерозирующего холангита |
|
1) Ильинский И.М., Цирульникова О.М. Первичный билиарный холангит. Вестник трансплантологии и искусственных органов. 2021;23(1):162-170.
2) Соколова Е.А., Бацких С.Н., Винницкая Е.В. Клинико-лабораторные особенности основных форм первичногобилиарного холангита. Эффективная фармакотерапия. 2025; 21 (2): 40–49
3) Решетняк В.И., Маев И.В. Патофизиология образования антимитохондриальных антител при первичномбилиарном холангите. Имеется ли дисфункция иммунной системы при ПБХ? Эффективная фармакотерапия. 2025; 21 (2): 28–39.
4) Маев И.В., Решетняк В.И. Механизм развития лабораторных признаков при первичном билиарном холангите и их диагностическое значение. Эффективная фармакотерапия. 2024; 20 (18): 42–60.
5) Бакулин И.Г., Сказываева Е.В., Скалинская М.И. Первичный билиарный холангит: современные представления о диагностике и лечении. Opinion leader. 2020 г.
6) Lindor KD, Bowlus CL, Boyer J, Levy C, Mayo M. Primary Biliary Cholangitis: 2018 Practice Guidance from the American Association for the Study of Liver Diseases. Hepatology. 2019 Jan;69(1):394-419. doi: 10.1002/hep.30145
7) European Association for the Study of the Liver. EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. J Hepatol. 2017 Jul;67(1):145-172. doi: 10.1016/j.jhep.2017.03.022
8) Gulamhusein AF, Hirschfield GM. Primary biliary cholangitis: pathogenesis and therapeutic opportunities. Nat Rev Gastroenterol Hepatol. 2020 Feb;17(2):93-110. doi: 10.1038/s41575-019-0226-7
9) Colapietro F, Lleo A, Generali E. Antimitochondrial Antibodies: from Bench to Bedside. Clin Rev Allergy Immunol. 2022 Oct;63(2):166-177. doi: 10.1007/s12016-021-08904-y
10) Rigopoulou EI, Bogdanos DP. Role of autoantibodies in the clinical management of primary biliary cholangitis. World J Gastroenterol. 2023 Mar 28;29(12):1795-1810. doi: 10.3748/wjg.v29.i12.1795