Недостаточность протеина С, протеина S и антитромбина III
Автор: Дарья Банина
Введение
Тромбообразование – нормальный процесс образования сгустков крови в ответ на повреждения сосудистой стенки с целью остановки кровотечения и обеспечения целостности сосудистой системы [25]. Патологическим тромбозом называют состояния, когда тромботический процесс становится избыточным или является самостоятельной причиной повреждения сосудов [25]. Термин венозные тромбоэмболические осложнения (ВТЭО) объединяет понятия патологических тромбозов и включает в себя тромбоз подкожных, глубоких вен и легочную тромбоэмболию [26].
ВТЭО — это полиэтиологическая и многофакторная патология. К развитию ВТЭО приводят нарушение кровообращения, повреждение эндотелия сосудистой стенки, повышенная способность крови к образованию тромба (гиперкоагуляция и ингибирование фибринолиза) [26]. К инициации венозного тромботического процесса приводит как воздействие всех трех составляющих, так и сильное и длительное воздействие двух и даже одного из вышеперечисленных факторов [24]. Современные представления о причинах возникновения тромбоза укладываются в понятие триады Вирхова, впервые предложенной в середине 19 века. На сегодняшний день триада претерпела изменения и была дополнена, но тем не менее сохранила в том или ином виде три ключевых фактора, способствующие развитию тромбоза [24].
Тромбофилия - патологическое состояние, которое характеризуется повышенной склонностью к образованию тромбов или внутрисосудистому свертыванию. Тромбофилии классифицируют на наследственные и приобретенные состояния. На сегодняшний день к врожденным причинам тромбофилии относят, наряду с дефицитом протеина С (PC), протеина S (PS) и антитромбина III (AT III), лейденскую мутацию V фактора свертывания крови, мутацию протромбина G20210A, гипергомоцистеинемию [24,25,26].
Генетические причины дефицитов PC, PS, AT III были открыты в 1960-1980 годах, но до сих пор остаются мало изученными и представляют широкий интерес в клинической и лабораторной практике. Рутинная лабораторная диагностика вышеперечисленных дефицитов основана на функциональных или иммунологических методах исследования, но не все типы дефицитов могут быть выявлены данными способами. Молекулярный же анализ позволяет выявить генетические варианты, ассоциированные с фенотипическими проявлениями и таким образом способствовать более достоверному определению типа дефицита. В перспективе комплексная диагностика, основанная на функциональных, иммунологических и молекулярно-генетических методах анализа может привести к более персонифицированному подходу, как в постановке диагноза, так и в назначаемом лечении. [24,25].
Протеин С
Протеин С (PC) - витамин К-зависимый гликопротеин плазмы, который является ферментом и ключевым компонентом антикоагулянтной системы. Протеин С синтезируется в гепатоцитах и циркулирует в плазме в виде гетеродимерного комплекса, состоящего из тяжелой и легкой цепи. Физиологическая активация протеина С происходит на поверхности эндотелиальных клеток с помощью тромбин-тромбомодулиного комплекса. Активация происходит при помощи двух мембранных рецепторов: эндотелиального рецептора протеина С и тромбомодулина. Оба являются необходимыми кофакторами для опосредованного тромбином превращения протеина С в активированный протеин С (APC). Активированный протеин С действует как сериновая протеаза, разрушая активированные формы факторов свертывания крови V и VIII, таким образом ингибируя выработку тромбина.
Помимо антикоагулянтной функции, активированный протеин С также проявляет мощные цитопротекторные и противовоспалительные свойства. В последнее время данные функции APC тщательно изучаются [1].
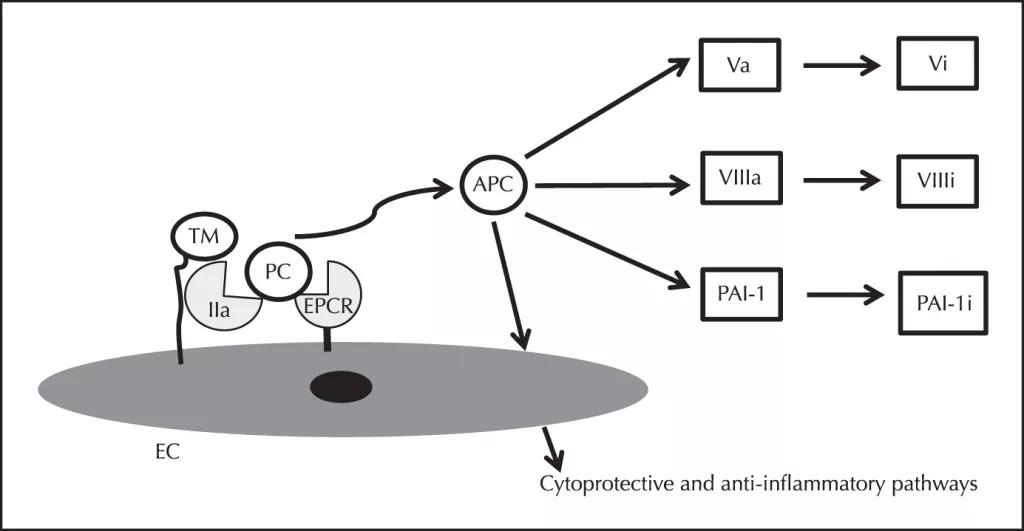
Рисунок 1. Биологическая роль протеина С (РС). Протеин C активируется до активированного протеина C (APC), который инактивирует факторы Va и VIIIa и ингибитор активатора плазминогена-1 (PAI-1). Активированный протеин С также активирует противовоспалительные пути внутри эндотелиальных клеток (ЭК). Сокращения: EPCR -эндотелиальный рецептор протеина C; ТМ-тромбомодулин [1].
Ген PROC
Протеин С кодируется геном PROC, расположенном на 2 хромосоме, регион 2q13-14. Ген содержит 9 экзонов, в том числе один нетранслируемый экзон, и восемь интронов. Длина гена PROC около 11 т.п.н. По данным Human Gene Mutation Database (HGMD) описано более 300 генетических вариантов гена PROC. Наиболее распространенными вариантами являются миссенс- и нонсенс-замены. Генетические варианты распределены по всему гену PROC. Стоит отметить, что согласно популяционным базам данных как жителей РФ (RUSeq), так и жителей стран мира (ClinVar, Gnomad), генетические варианты наиболее распространены в 9 экзоне. Этот факт также подтверждают проведенные исследования в ряде стран Европы [3,4,9,27].
По данным RUseq описано 106 генетических вариантов гена PROC, встречающихся среди жителей РФ [2]. Из них 44 варианта являются миссенс-заменами, 20 вариантов располагаются в области интронов, 16 вариантов представлены синонимичными заменами. Помимо этого, небольшой процент вариантов располагается в нетранслируемых регионах (3' UTR), нетранслируемом первом экзоне и регионах сайта сплайсинга. По данным ClinVar в гене PROC описано 65 патогенных, 55 вероятно патогенных и 120 вариантов с неопределенной значимостью.
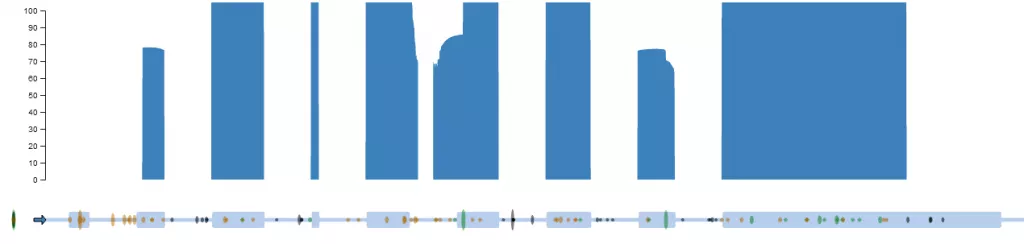
Рисунок 2. Локализация генетических вариантов гена PROC. Синим цветом продемонстрировано покрытие кодирующей части гена PROC. По данным RUseq.
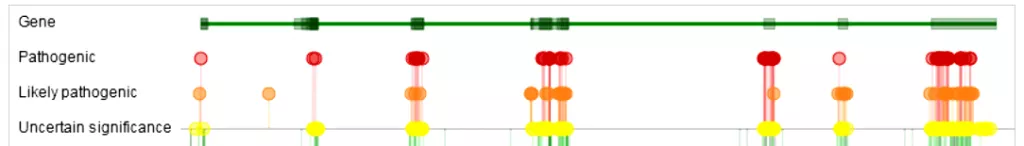
Рисунок 3. Локализация генетических вариантов гена PROC. По данным СlinVar
Дефицит протеина С носит как приобретенный, так и наследственный характер. Приобретенный дефицит может быть вызван заболеваниями печени, приемом антагонистов витамина К, тяжелыми инфекциями [3].
Наследственный дефицит протеина С — заболевание с аутосомно-доминантным типом наследования с неполной пенетрантностью, которое вызвано патогенными генетическими вариантами в гене PROC. Частота встречаемости в популяции составляет 0,2-0,3%. Частота встречаемости генетических вариантов среди больных с ВТЭО составляет 3-5%.
Выделяют два типа наследственного дефицита протеина С. I тип встречается в 75–80% случаях и представляет собой количественный дефект протеина С. II тип представляет собой функциональный дефект. II тип характеризуется сниженной активностью фермента протеина С с сохранением его концентрации. II тип подразделяют на IIа и IIb подтипы. Большинство случаев дефицита подтипа IIa вызваны генетическими вариантами в ферментативном сайте APC. Подтип IIb ассоциирован с вариантами, вызывающими структурные изменения протеина С и влияющие на взаимодействие с другими белками (протеином S, факторами V и VIII), фосфолипидами или кальцием [3,4].
Большинство пациентов имеют гетерозиготный генотип. Клиническая картина в таких случаях варьирует от бессимптомного течения до ВТЭО. У пациентов с умеренно выраженным дефицитом протеина С описаны случаи рецидивирующих ВТЭО, включая тромбоз глубоких вен (ТГВ), легочную эмболию (ЛЭ), паренхиматозные тромбы и склонность к ДВС-синдрому. При этом у таких пациентов клинические проявления могут не проявляться до подросткового возраста. Кроме этого, потенциальным осложнением дефицита протеина С является некроз кожи, вызванный варфарином. В таких случаях в анамнезе у пациента отмечаются жалобы на боль, синяки и покраснения в пораженной области. В дальнейшем клиническая картина развивается до четко очерченного воспаленного очага, что в конечном итоге приводит к некрозу кожи [1].
Гомозиготные носители встречаются крайне редко, что обусловлено гибелью плода или перинатальной смертностью. У гомозиготных и компаунд-гетерозиготных пациентов с низким уровнем активности протеина С дефицит проявляется в виде ДВС-синдрома, а также вызывает ВТЭО и молниеносную пурпуру. Как правило, пурпура проявляется у новорожденных вскоре после рождения в виде петехий и синяков на коже. Чаще всего наблюдается в областях, подвергающихся давлению, например, на ягодицах [1].
Диагностика недостаточности протеина С проводится с целью выявления наследственных тромбофилий наряду с диагностикой недостаточности других факторов - протеина S и антитромбина III.
В рутинной практике используют два основных лабораторных теста для диагностики дефицита протеина С: тесты определения концентрации белка и тесты измерения активности. Тесты измерения активности оценивают с помощью показателей времени свертывания или показателей хромогенного метода исследования.
Тесты определения активности (% активности белка)
Для измерения активности протеин С, присутствующий в плазме пациента, активируют до АРС с помощью фермента Protac®. Далее уровень генерируемого APC оценивают с помощью хромогенного метода исследования или с помощью тестов на основе времени свертывания.
Согласно рекомендациям международного сообщества специалистов по тромбозу и гемостазу (ISTH) предпочтительным скрининговым тестом является хромогенный метод измерения активности (кинетический) ввиду его высокой специфичности. Однако стоит отметить, что хромогенные субстраты взаимодействуют только с активным центром APC. Таким образом, данный тип исследования способен выявить только функциональные дефекты протеина С, затрагивающие активный центр (Таблица 1) [7].
Редкие дефекты IIb типа требуют проведения определения активности с помощью тестов на основе времени свертывания. Диагностика на дефицит IIb типа позволяет оценить способность протеина С взаимодействовать с тромбином, эндотелиальным рецептором PC, фосфолипидом или белком S [7].
Тесты определения концентрации
Тесты определения концентрации белка используют для оценки количества протеина С, но не применяют для оценки функции белка. Согласно рекомендациям ISTH данный тип теста не рекомендуется для проведения в рутинной практике.
В таблице 1 приведена сравнительная характеристика используемых методов для диагностики различных типов дефицита протеина С.
Таблица 1. Сравнительная характеристика используемых лабораторных методов в рутинной практике для диагностики дефицита протеина С. По данным литературы [7].
|
|
Тип теста |
Принцип метода |
I тип |
II тип |
|
|
IIа |
IIb |
||||
|
Тесты определения активности |
Хромогенный |
Активация РС ферментом Protac -> АРС расщепляет хромогенный субстрат -> измерение уровня высвобожденного хромогена |
+ |
+ |
- |
|
На основе показателей времени свертывания |
Активация РС ферментом Protaс -> инактивация факторов Va и VIIIa -> измерение уровня АЧТВ |
+ |
+ |
+ |
|
|
Активация ферментом Protaс -> инактивация факторов Va и VIIIa -> измерение уровня волчаночного антикоагулянта |
+ |
+ |
+ |
||
|
Тесты определения концентрации белка |
|
Радиальная иммунодиффузия/ иммуноэлектрофорез |
+ |
- |
- |
|
ИФА |
+ |
- |
- |
||
Стоит отметить, что немаловажное влияние на достоверные результаты лабораторных исследований оказывают преаналитические факторы. Так как протеин С очень лабилен важно соблюдать все правила данного этапа исследования. Так, к недостоверным результатам приводят нарушение правил транспортировки, условий хранения и истечение допустимого временного интервала после забора образца. Необходимо акцентировать внимание пациента на необходимость прекращения терапии антагонистами витамина К за 10 дней после приема последней дозы перед проведением лабораторной диагностики. Нарушение всех перечисленных условий приводит к ложным результатам исследований. Сложность преаналитического этапа является важным недостатком вышеперечисленных методов анализа.
Генетические варианты гена PROC
Как было упомянуто выше, по последним данным описано более 300 генетических вариантов гена PROC. Так, 95-97% патогенных вариантов гена PROC представляют собой замену одного основания (миссенс или нонсенс-варианты) или небольшую делецию или вставку, а в 3-5% случаев встречаются протяженные делеции или дупликации, затрагивающие несколько экзонов [7,9].
Ген PROC не содержит «горячих точек» - наиболее распространенных генетических вариантов, приводящих к дефициту протеина С. Этот факт подтверждают проведенные исследования как в странах Европы (Польша, Германия, Дания), так и Восточной Азии (в том числе в отдельных регионах Китая). В каждом таком исследовании были выявлены как ранее описанные, так и большое количество новых вариантов [3,4,9,27]. Однако было показано, что в некоторых экзонах патогенные варианты встречаются чаще. Проведенные группой Wypasek E. et al исследования у пациентов с ВТЭО в Польше продемонстрировали, что большинство встреченных генетических вариантов гена PROC располагались в 5, 7, 9 экзонах. Наиболее распространенными вариантами являлись миссенс-замены p.Cys387Tyr, p.Val434Ala, p.Leu320Pro, расположенные в 9 экзоне, внутри области, кодирующей каталитический домен. Авторы отмечают, что данные варианты потенциально влияют на функцию связывания белка с субстратом, но для оценки патогенности необходимо дальнейшее изучение и проведение функциональных исследований с использованием в том числе программ предикторов [27].
Проведенное исследование Alhenc-Gelas M. et al во Франции также продемонстрировало превалирующую распространённость миссенс-вариантов. Однако миссенс-замены отличались от выявленных в Польше и Германии [9,27]. Также было выявлено 84 новых, раннее не описанных варианта.
Таблица 2. Некоторые описанные варианты гена PROC, обнаруженные у пробандов во Франции. По данным литературы [4].
|
Генетический вариант |
Выявленное количество |
|---|---|
|
p.Arg189Trp |
20 |
|
p.Phe118Leu |
23 |
|
p.Gly239Arg |
23 |
|
p.Pro321Leu |
24 |
|
p.Arg40Cys |
25 |
|
p.Pro96Ser |
25 |
|
p.Leu265Phe |
26 |
|
p.Val339Met |
29 |
|
c.678 + 9C > T |
29 |
|
p.Arg57Trp |
37 |
|
p.Pro210Leu |
42 |
|
p.Arg220Gln |
64 |
Caspers M. et al. продемонстрировали, что частота встречаемости и профиль генетических вариантов в Германии соответствует ранее описанным в Европе (Рисунок 4) [3,4,27]. В данном исследовании была представлена локализация обнаруженных вариантов в гене PROC (Рисунок 5). Можно обратить внимание, что большинство миссенс-замен располагалось в 9 экзоне. Также исследователи обращают внимание на небольшой процент (3%) обнаруженных крупных делеций, которые во всех случаях охватывают 6 и 7 экзоны (Рисунок 5). Помимо этого, у четырёх пациентов были обнаружены компаунд-гетерозиготные генотипы, сочетавшие в себе миссенс-замены, небольшие делеции и варианты, затрагивающие сайт сплайсинга [9].
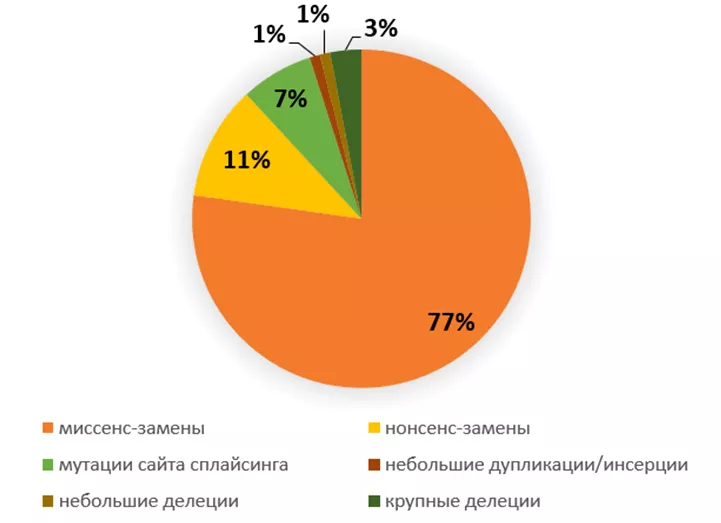
Рисунок 4. Профиль генетических вариантов гена PROC, обнаруженных среди пациентов в Германии. По данным литературы [9].
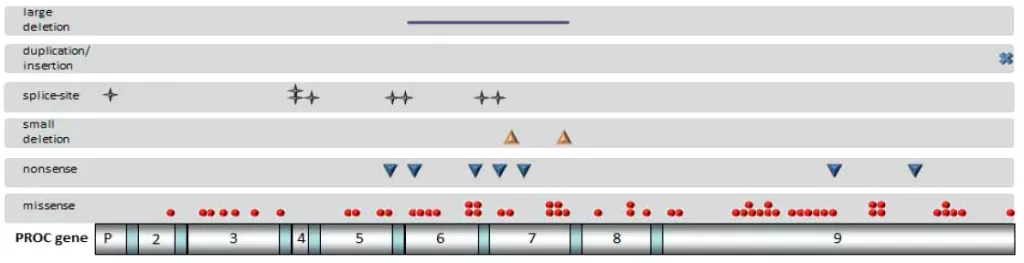
Рисунок 5. Генетические варианты и их локализация в гене PROC, обнаруженные среди пациентов в Германии. По данным литературы [9].
Согласно рекомендациям ISTH генетический анализ является вспомогательным в диагностике недостаточности протеина С. Молекулярная диагностика играет роль в подтверждении тяжелого дефицита протеина С, включая случаи пренатальных диагнозов, а также способствует выявлению недостаточности протеина С среди членов семьи [7,9]. Однако важно отметить, что большинство исследователей приходят к выводу, о целесообразности проведения молекулярно-генетического метода исследования при снижении активности протеина С ниже 70% [3,4,9]. При уровне активности протеина С выше 70% проведение молекулярной диагностики не рекомендуется из-за низкой вероятности обнаружения генетических вариантов [9].
Протеин S
Биологическая роль протеина S
Протеин S (PS) - витамин К-зависимый белок плазмы. Протеин S выступает в качестве неферментативного кофактора для активированного протеина С, способствуя инактивации факторов Va и VIIIa, таким образом ингибируя процесс свертывания. Также протеин S является кофактором белка-ингибитора пути тканевого фактора (TFPI), который ингибирует активность тканевых факторов, что в свою очередь приводит к инактивации фактора Xa [13]. Протеин S синтезируется преимущественно гепатоцитами, а также макрофагами, эндотелиальными и другими клетками. Начиная с N-конца, белок содержит витамин К-зависимый домен, называемый «домен Gla», чувствительный к тромбину. Кроме того, протеин S cодержит четыре последовательных домена, подобных эпидермальному фактору роста (EGF), отличающиеся высокой способностью связывать кальций. На С-конце белок имеет гомологичный плазменный глобулин, связывающий половые гормоны (SHBG), который имеет две ламинин G-подобные структуры (LG1, LG2) [31]. SHBG-подобный домен используется для взаимодействия с C4BPA.
Протеин S существует в плазме в двух формах: свободной, функционально активной форме и неактивной форме в комплексе с C4b-связывающим белком (C4BPA), связанным с помощью SHBG-подобного домена. При этом в плазме 40% протеина S представлено в свободной форме и 60% в связанной (неактивной).
Ген PROS1 имеет транскрипционно молчащий псевдоген (PROSP), который расположен вблизи к PROS1. Псевдоген PROSP на 95 и 97% сходен с PROS1 по интронам и экзонам соответственно, за исключением экзона 1, который отсутствует в PROSP. Стоит отметить, что наличие псевдогена и большой размер гена усложняют изучение вариантов гена PROS1.
По данным ClinVar в гене PROS1 описано 62 патогенных, 48 вероятно патогенных и 189 варианта с неопределенной значимостью. Ген PROS1 не имеет “горячих точек”, генетические варианты распределены по всему гену (Рисунок 6).
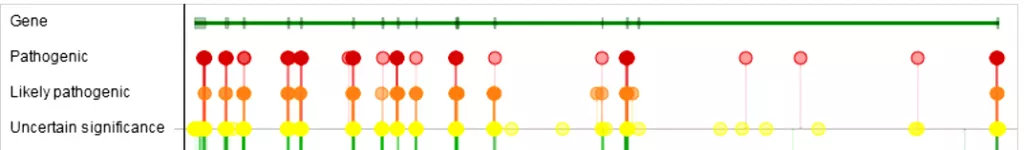
Рисунок 6. Локализация генетических вариантов гена PROS1. По данным СlinVar.
Дефицит протеина S
Дефицит протеина S может быть как приобретенным, так и наследственным. Приобретенный дефицит, как правило, обусловлен заболеванием печени, хроническими инфекциями, нефротическим синдромом или дефицитом витамина К.
Наследственный дефицит белка S (PSD) — аутосомно-доминантное заболевание с неполной пенетрантностью, вызванное генетическими вариантами в гене PROS1. Наследственный дефицит протеина S подразделяют на 3 типа:
-
I тип (количественный) с функциональной недостаточностью протеина S и низкими уровнями свободного и тотального протеина S;
-
II тип (качественный) с функциональной недостаточностью протеина S и уровнем свободного и тотального протеина S в пределах референтных значений;
-
III тип (смешанный) с функциональной недостаточностью протеина S, низким уровнем свободного и уровнем тотального протеина S в пределах референтных значений.
У 95% пациентов обнаруживается дефицит I или III типа. ВТЭО являются основными клиническими проявлениями у большинства пациентов с гетерозиготными вариантами гена PROS1. В подавляющем большинстве случаев клиническая картина представлена тромбозом глубоких вен нижних конечностей и тромбоэмболией легочной артерии. По данным Chan N et al. и Wypasek E et al. варианты в гене PROS1 связаны не только с повышенным риском развития венозного тромбоза [10], но и увеличивают риск артериальной эмболии, что приводит, в том числе, к инфаркту мозга и миокарда [11]. Около половины пациентов с дефицитом протеина S развивают симптомы в возрасте до 55 лет, в то время как у некоторых из них не возникает осложнений за всю жизнь [13].
У пациентов с ВТЭО предполагаемая распространенность наследственного дефицита протеина S варьирует от 2–5% до 1–13% у отдельных пациентов из семей с установленными случаями тромбофилии. В общей популяции оценки резко различаются между 0,03 и 0,13% [12].
Лабораторные методы диагностики недостаточности протеина S
Рутинная диагностика дефицита протеина S основана на определении уровней тотального (общего) и свободного антигенов протеина S. Помимо этого используются тесты определения активности протеина S, где протеин S выступает в качестве кофактора APC [22].
Также как и в случае с протеином С проведение лабораторной диагностики требует строгого соблюдения правил преаналитического этапа из-за высокой лабильности протеина S. Помимо этого на лабораторные показатели протеина S оказывают влияние ряд факторов. К ним относят возраст, пол, беременность, использование пероральных контрацептивов, прием антагонистов витамина К и пероральных антикоагулянтов прямого действия, полиморфизмы в гене PROS1 [22].
Тесты определения концентрации
Согласно рекомендациям ISTH в настоящее время в качестве скринингового метода диагностики дефицита протеина S используется тест оценки концентрации свободного протеина S (free PS antigen assay) [14].
Уровень свободного протеина S определяют иммунологическими методами с использованием моноклональных антител к несвязанной (антикоагулянтной) форме протеина S. Как правило, используются фотометрические методы. Тесты на основе ИФА использовать не рекомендуется. Ограничивающим фактором теста определения свободного протеина S является неспособность идентифицировать дефицит II типа.
Согласно рекомендациям ISTH тесты определения тотальной концентрации протеина S (total PS antigen assay) могут быть выполнены с целью дифференциации I и III типа дефицита. Однако такой тип тестов малоинформативен и, как правило, не проводится лабораториями [14].
Тесты определения активности (% активности белка)
Определение активности протеина S основано на его роли кофактора для APC. Принцип метода заключается в проведении измерения антикоагулянтной активности с использованием тестов протромбинового времени, активированного частичного тромбопластинового времени (АЧТВ), фактора Ха или волчаночного антикоагулянта. Время свертывания крови каждого из этих анализов прямо пропорционально концентрации протеина S в плазме образца. Преимущество тестов определения активности – это способность выявления как качественных (тип II), так и количественных дефектов (тип I и тип III).
Тест определения активности протеина S имеет чувствительность больше 90%, но умеренную специфичность от 40% до 70%. При этом в большинстве коммерческих тестов были обнаружены ложно заниженные значения от 10% до 15% образцов плазмы крови здоровых людей [14].
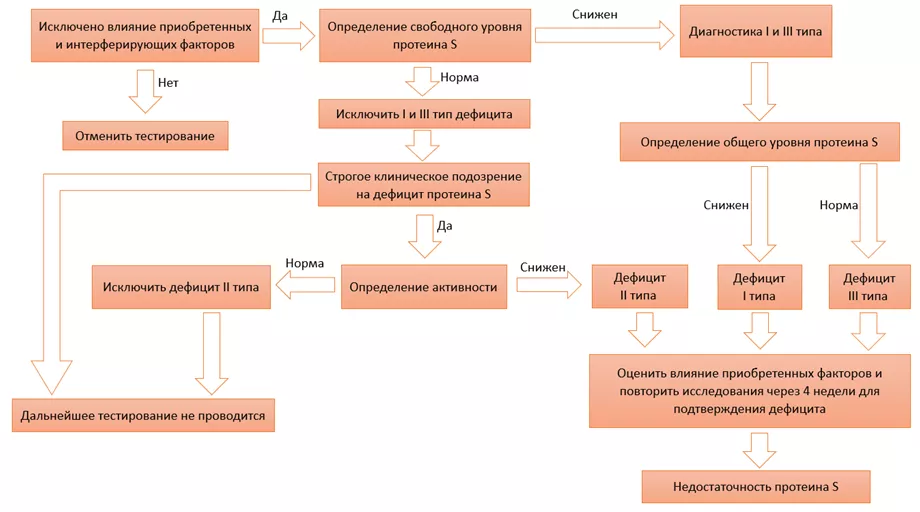
Рисунок 7. Алгоритм диагностики дефицита протеина S. По данным клинических рекомендаций [14]; развернуть изображение на весь экран
Таблица 3. Классификация дефицита протеина S и методы диагностики типов дефицита. По данным клинических рекомендаций [14]
|
Тип дефицита |
Тесты определения концентрации |
Тесты определения активности |
|
|
Общий |
Свободный |
||
|
Тип I |
Cнижен |
Cнижен |
Cнижен |
|
Тип II |
N |
N |
Cнижен |
|
Тип III |
N |
Cнижен |
Cнижен |
Генетические варианты
Как было упомянуто выше, на сегодняшний день описано более 400 вариантов гена PROS1. Варианты, вызывающие количественный дефицит протеина S, распределены по всему гену.
Варианты, вызывающие качественный дефицит протеина S, локализуются в Gla и EGF-подобных доменах. Так в проведённом исследовании Li L. et al. в Китае были продемонстрированы частоты шести типов генетических вариантов гена PROS1 в различных функциональных доменах (Рисунок 8) [29].
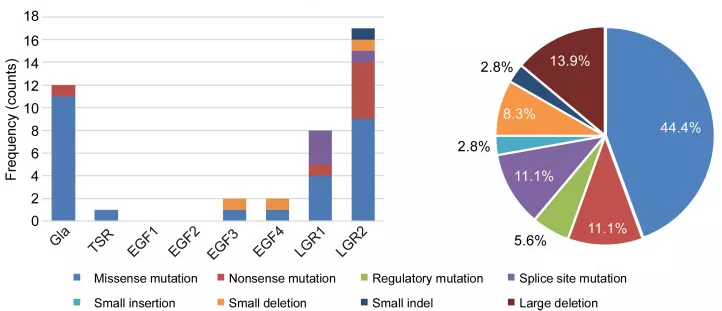
Рисунок 8. Слева - гистограмма, представляющая спектр вариантов гена PROS1 в различных функциональных доменах. Справа - круговая диаграмма - частота встречаемости спектра вариантов среди обследованных пробандов в Китае. По данным литературы [29].
По данным литературы варианты гена PROS1 более распространены в странах Азии. При этом распространенность генетических вариантов в некоторой степени различаются и среди населения данных стран [14,15,29]. Так, например, миссенс-вариант PS Tokushima (p.Lys196Glu), является наиболее распространенным вариантом, приводящей к дефициту протеина S II типа в Японии и увеличивает риск ВТЭО примерно в 4-8 раз у гетерозиготных пациентов [14, 15]. В исследовании Li L. et al. проведенном в Китае, наоборот, не был обнаружен вариант PS Tokushima, но были описаны три других преобладающих варианта у пациентов с дефицитом протеина S - p.Glu67Ala, p.Arg561Trp и p.Tyr560*[29].
Среди всего населения Европы описан другой наиболее распространённый миссенс-вариант – PS Heerlen (p.Ser501Prо). Данный вариант встречается с частотой в 0,5% и ассоциирован с дефицитом протеина S III типа. Однако значимость патогенности этого варианта остается неподтвержденной [14].
При этом среди европейского населения вероятно также распространены другие генетические варианты. Так группа Larsen O. H. et al в Дании обнаружила в выборке пациентов наиболее распространенный вариант – p.Glu390Lys. Интересен тот факт, что более ранние исследования предполагают, что вариант p.Glu390Lys является вариантом-основателем именно в Дании [30].
Согласно рекомендациям ISTH и Британского сообщества гематологов (BSH) молекулярную диагностику следует проводить наряду с рутинными лабораторными методами диагностики, но генетическое тестирование не должно полностью заменять их [14,32]. При этом сообщества отмечают, что проведение генетического тестирования считается более широким подходом в диагностике дефицита протеина S. Как правило, на сегодняшний день выявление генетических вариантов проводят в случаях подозрения на наследственный дефицит и в качестве дополнительного метода исследования.
Антитромбин III
Биологическая роль антитромбина
Антитромбин (АТ, АТ III) – плазменный гликопротеин суперсемейства серпинов. АТ синтезируется в печени и в сосудистом эндотелии. АТ выполняет функцию ингибитора сериновых протеаз, регулируя протеолитическую активность прокоагулянтных протеаз как внутреннего, так и внешнего путей. АТ может ингибировать все прокоагулянтные протеазы каскада свертывания крови, но его основными мишенями являются тромбин, факторы Ха и IXa .
Белок АТ имеет два функциональных домена: гепаринсвязывающий домен на N-конце зрелого белка и домен реактивного сайта на С-конце. При этом АТ представляет собой гепарин-связывающий серпин, то есть реактивность белка по отношению к протеазам коагуляции заметно увеличивается, при связывании гепарина с несколькими основными остатками серпина. В отсутствие гепарина АТ проявляет относительно низкую реакционную способность по отношению к протеазам свертывания крови. Этим объясняется терапевтическое применение гепарина в качестве антикоагулянта.
В дополнение к своей антикоагулянтной функции АТ вызывает мощный противовоспалительный сигнальный ответ, когда он связывается с отдельными гепарансульфатными протеогликанами (HSPG) сосудистых эндотелиальных клеток, тем самым индуцируя синтез простациклина [18].
Ген SERPINC1
Антитромбин кодируется геном SERPINC1, который располагается на 1 хромосоме с локализацией 1q25. Ген SERPINC1 содержит семь экзонов и шесть интронов и охватывает около 14 т.п.о.
Известно, что промоторная область гена четко не определена и не содержит ТАТА-бокс. Основные функциональные домены антитромбина – домен активного сайта и гепарин связывающий домен, кодируются 6 и 2 экзоном, соответственно.
На сегодняшний день по данным HGMD описано более 400 вариантов гена SERPINC1, связанных с дефицитом антитромбина. Профиль генетических вариантов гена SERPINC1 гетерогенен. Большая часть генетических вариантов представлена точечными заменами, вариантами сайта сплайсинга и небольшими инсерциями/делециями, грубые перестройки встречаются гораздо реже. Малые делеции и инсерции затрагивают, как правило, 7 экзон или фланкирующие области [19,20,21].
Ген SERPINC1 не содержит “горячих точек” – наиболее распространенных вариантов в популяции. Генетические варианты распределены по всему гену SERPINC1. По данным ClinVar в гене SERPINC1 описано 122 патогенных, 44 вероятно патогенных и 86 вариантов с неопределенной значимостью. По данным RUseq на территории РФ описан 51 генетический вариант гена SERPINC1. Из них 23 варианта являются миссенс-заменами,12 вариантов располагаются в области интронов, 9 вариантов представляют собой синонимичные замены, 1 вариант расположен в сайте сплайсинга и 4 варианта локализуются в некодирующей области (5’UTR).
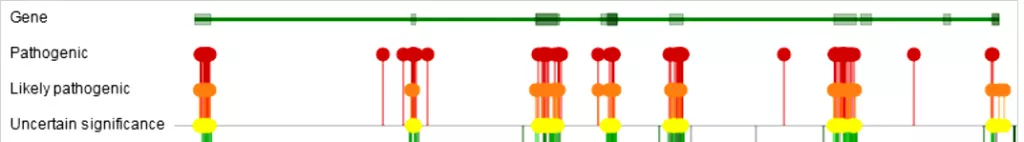
Рисунок 9. Локализация генетических вариантов гена SERPINC1. По данным СlinVar.
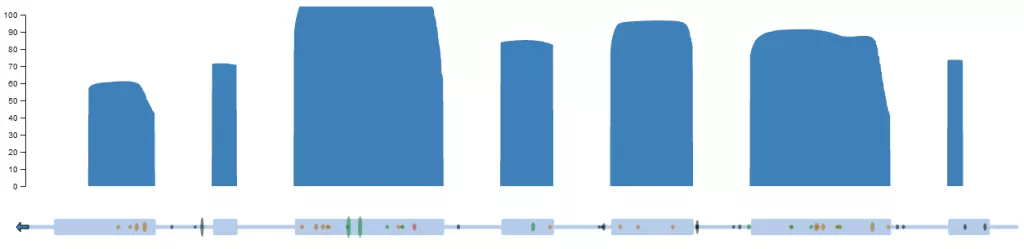
Рисунок 10. Локализация генетических вариантов гена SERPINC1. Синим цветом продемонстрировано покрытие кодирующей части гена SERPINC1. По данным RUseq.
Дефицит антитромбина
Дефицит антитромбина может носить как приобретенный, так и наследственный характер. Приобретенный дефицит встречается у пациентов с ДВС-синдромом. Приобретенный дефицит может быть вызван дисфункцией печени, протеинурией, болезнью Крона или язвенным колитом.
Наследственный дефицит является аутосомно-доминантным заболеванием с неполной пенетрантностью и вызван патогенными вариантами в гене SERPINC1. Недостаточность антитромбина приводит к высокому риску развития ВТЭО [18]. Частота встречаемости среди здорового населения составляет 0.02%–0.17%, у пациентов с ВТЭО распространенность составляет 1–5%. Первые симптомы у пациентов проявляются в среднем до 40 лет [20,22].
Выделяют два типа дефицита. Дефицит I типа является количественным и характеризуется сниженной активностью и низкими концентрациями белка. В этом случае процентное соотношение показателей уровня антигена к уровню антикоагулянтной активности близка к 1. Дефицит типа II является качественным и характеризуется выработкой варианта белка с нарушенной или нулевой антикоагулянтной активностью. Процентное соотношение показателей уровня антигена к уровню антикоагулянтной активности в данном случае выше 1 [19].
Дефицит II типа делится на три подтипа:
Подтип IIa, или RС, связан с изменением в области реактивного центра белка. При таком типе дефицита снижается реактивность белка с целевой протеазой или происходит нарушение процесса ингибирования. Большинство генетических вариантов, вызывающих данный тип дефицита, влияют на аминокислотные остатки петли реактивного центра (RCL-reactive centre loop).
При дефекте типа IIb, или HBS, нарушается взаимодействие гепарина с антитромбином или происходит нарушение активации, индуцированная этим связыванием. В данном случае варианты обычно локализуется в гепарин связывающем домене (HBS). Дефицит HBS II типа присутствует примерно у 0,03%-0,04% населения в целом [18, 22].
Третий тип – IIc, или РЕ, называют плейотропным. Патогенные варианты затрагивают и сайт связывания гепарина, и области, влияющие на стабильность белка [19].
Гомозиготный дефицит антитромбина I типа считается несовместимым с жизнью. У гомозиготных пациентов с HBS II типа описаны более тяжелые клинические проявления ВТЭО. Пациенты с гетерозиготным генотипом IIb HBS имеют более низкий риск развития ВТЭО по сравнению с пациентами I, IIa и IIc типов дефицита [19].
Лабораторные методы диагностики недостаточности антитромбина III
В рутинной лабораторной диагностике дефицита антитромбина применяют два основных метода исследования. К ним относят тесты определения активности и концентрации антитромбина.
Тесты определения активности (% активности белка)
Согласно рекомендациям ISTH первый этап диагностики дефицита антитромбина включает в себя определение уровня активности [22]. Тесты определения активности антитромбина проводят с помощью хромогенных амидолитических методов на основе фактора IIa (тромбина) или фактора Ха.
Также в рекомендациях ISTH описан метод диагностики прогрессирующей активности, позволяющий дифференцировать варианты HBS от других подтипов дефицита II типа. При использовании данного метода у пациентов с вариантами HBS результаты определения активности находятся в пределах референтных значений, но при использовании метода хромогенного анализа уровни активности снижены [22]. При дефиците RS II типа уровни активности антитромбина снижены как при измерении прогрессивным, так и хромогенным методом (Таблица 4).
Однако метод прогрессирующей активности имеет более низкую специфичность и ряд ограничений [22]. Так, например, вариант типа RS Cambridge II (p.Ala416Ser), является исключением. У пациентов с описанным вариантом были зафиксированы уровни активности характерные для вариантов HBS.
Тесты определения концентрации
Определение концентрации антитромбина III на первом этапе диагностики не проводят. Это объясняется тем фактом, что уровни антигена при II типе дефицита находятся в пределах референтных значений, независимо от того, имеет ли белок функциональную активность или нет. Согласно рекомендациям BSH определение уровня антигена проводят после подтвержденного сниженного уровня активности [32].
Современные методы, которые используют для определения уровня антигена антитромбина, включают в себя иммуноферментный анализ (ИФА), однонаправленный простой иммуноэлектрофорез, радиальную иммунодиффузию и иммунотурбидиметрические методы [19]. Наиболее активно используемым методом является ИФА.
В таблице 4 приведены типы недостаточности, методы лабораторной диагностики и спектр встречающихся вариантов гена SERPINC1.
Таблица 4. Типы дефицита антитромбина, методы лабораторной диагностики и описанные генетические варианты. По данным литературы [19]
|
Тип |
Подтип |
Тесты определения активности |
Тесты определения уровня концентрации |
Генетические варианты |
|
|
Хромогенная |
Прогрессирующая |
||||
|
I |
|
40-60% |
40-60% |
40-60% |
Нонсенс-замены, сдвиг рамки считывания, мутации сайта сплайсинга, миссенс-замены, малые делеции/инсерции |
|
II
|
RS |
40-60% |
40-60% |
80-100% |
Миссенс-замены (в петле реактивного центра) |
|
HBS |
40-60% |
80-100% |
80-100% |
Миссенс-замены (в гепарин связывающем домене) |
|
|
PE |
40-60% |
40-60% |
80-100% |
Миссенс-замены (в С-листе) |
|
Согласно рекомендациям ISTH проведение молекулярной диагностики целесообразно у отдельных пациентов. Например, генетическое тестирование проводят в тех случаях, когда тесты определения активности и концентрации не позволяют дифференцировать все подтипы дефицита антитромбина. Так, генетическое тестирование позволяет обнаружить варианты Dublin, Wibble (p.Thr117Met) и Rouen VI (p.Asn219Asp). У пациентов с данными генетическими вариантами, как правило, результаты тестов активности и концентрации находятся в пределах референтных значений. Показатели тестов определения активности и концентрации снижаются при наличии определенных факторов, например при лихорадке или беременности [19,22].
На рисунке 11 продемонстрирован алгоритм молекулярной диагностики антитромбиновой недостаточности [19,22].
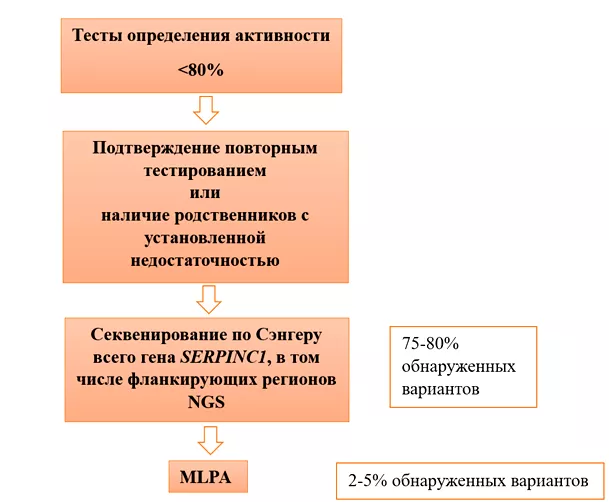
Рисунок 11. Алгоритм молекулярной характеристики антитромбиновой
недостаточности. По данным литературы [19]; развернуть изображение на весь экран
Генетические варианты
Наиболее распространенными генетическими вариантами гена SERPINC1 являются миссенс-замены. В таблице 5 приведен спектр вариантов гена SERPINC1, встречающихся среди пациентов
с антитромбиновой недостаточностью, которые были описаны в базе HGMD [19].
Таблица 5. Типы вариантов гена SERPINC, описанные у пациентов с антитромбиновой недостаточностью. По данным литературы [19]
|
Вариант |
Количество |
Тип дефицита |
|---|---|---|
|
Миссенс |
149 |
I или II |
|
Нонсенс |
26 |
I |
|
Делеция |
30 |
I |
|
Инсерция |
19 |
I |
|
Сайт сплайсинга |
22 |
I |
|
Малая делеция |
29 |
I |
|
Малые инсерции |
5 |
I |
|
Инсерции/делеции |
2 |
I |
|
Крупные делеции |
26 |
I |
|
Крупные инсерции/дупликации |
1 |
I |
|
Комплексная перестройка |
4 |
I |
В обзорной статье Corral J., et al. в 2018 году были продемонстрированы
варианты, описанные в гене SERPINC1 и
их локализация в трехмерной структуре антитромбина. На рисунке 12 варианты,
связанные с RS типа II, отмечены красным цветом, связанные с HBS типа II –
зеленым цветом, связанные с PE типа II – голубым цветом.
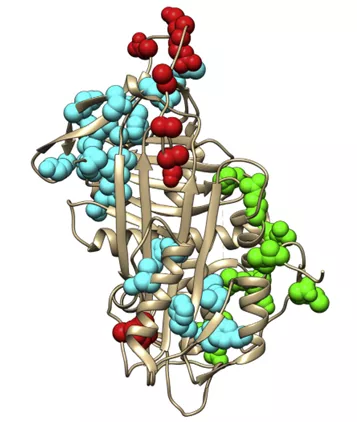
Рисунок 12. Локализация генетических вариантов гена SERPINC1 в трехмерной структуре молекулы антитромбина. По данным литературы [19]
Как было упомянуто выше, тесты определения активности и концентрации не во всех случаях способны выявить дефицит антитромбина. К таким случаям относят генетические варианты Cambridge II (p.Ala416Ser), Denver (p.Ser426Leu) и Stockholm (p.Gly424Asp), которые ассоциированы с дефицитом RS типа II. В рутинной лабораторной диагностике дефицит в таких случаях может быть установлен функциональным методом на основе тромбина, но не может быть определен функциональным методом с использованием фактора Ха [19].
Также на результаты лабораторной диагностики оказывают влияние концентрация и тип используемого гепарина, время инкубации, разведение образца, мишень протеазы (в том числе ее происхождение, человеческое или бычье). В таблице 6 перечислены генетические варианты, которые ассоциированы с соответствующим типом дефицита АТ и методы диагностики, применение которых ограничено в рутинной практике для этих вариантов.
Таблица 6. Варианты гена SERPINC1 и методы лабораторной диагностики, применение которых ограничено в рутинной практике. По данным литературы [19]
|
Вариант |
Название |
Тип дефицита |
Метод, ограниченный в применении для этого варианта |
Клиническая тяжесть |
|---|---|---|---|---|
|
p.Pro73Leu |
Basel |
Тип II HBS |
Хромогенный с использованием фактора IIa |
Умеренная |
|
p.Asn77His
|
|
Тип II HBS |
Хромогенный с использованием фактора IIa и Ха |
Умеренная |
|
p.Arg79Cys
|
Toyama
|
Тип II HBS |
Хромогенный с использованием фактора IIa |
Умеренная |
|
p.Arg79His
|
Rouen I
|
Тип II HBS |
Все методы |
Умеренная |
|
p.Leu131Phe
|
Budapest III
|
Тип II HBS |
Хромогенный с использованием фактора IIa |
Умеренная |
|
p.Lys146Glu
|
Dreux
|
Тип II HBS |
Длительная инкубация |
Умеренная |
|
p.Gln150Pro
|
Vienna
|
Тип II HBS |
Длительная инкубация |
Умеренная |
|
p.Arg161Gln
|
Geneva
|
Тип II HBS |
Длительная инкубация |
Умеренная |
|
p.Ala416Ser
|
Cambridge II
|
Tип II RS |
Хромогенный с использованием фактора Ха |
Легкая |
|
p.Gly424Asp
|
Stockholm
|
Tип II RS |
Хромогенный с использованием фактора Ха |
Тяжелая |
|
p.Arg425His
|
Glasgow
|
Tип II RS |
Длительная инкубация с использованием фактора IIa |
Тяжелая |
|
p.Ser426Leu
|
Denver
|
Tип II RS |
Хромогенный с использованием фактора Ха |
Тяжелая |
|
p.Val30Glu
|
Dublin
|
Транзиентная недостаточность |
Любой метод |
Умеренная |
|
p.Thr117Met
|
Wibble
|
Транзиентная недостаточность |
Любой метод |
Тяжелая |
|
p.Val137Ala
|
|
Транзиентная недостаточность |
Любой метод |
Тяжелая |
|
p.Asp219Asn |
Rouen VI |
Транзиентная недостаточность |
Любой метод |
Тяжелая |
Согласно обзорной статье Corral J., et al. у гена SERPINC1 описаны варианты, которые оказывают незначительное влияние на фолдинг или функцию белка антитромбина, таким образом, что не вызывают дефицит антитромбина в нормальных условиях. Однако такие варианты белка более чувствительны, чем антитромбин дикого типа, к приобретенным факторам или факторам окружающей среды (например, лихорадка). Только при совокупности определенных факторов такие варианты гена приведут к соответствующим функциональным дефектам и к последующему риску развития тромбоза [19].
Также в литературы была описана транзиентная недостаточность антитромбина. В исследовании Bravo‐Pérez C. et al. в Испании обследовали 444 пациента с предполагаемой антитромбиновой недостаточностью. В 31% случаях при первичном обследовании наблюдались снижения уровней активности антитромбина, а при повторном обследовании показатели активности располагались в пределах референтных значений. В 44% случаев среди таких пациентов с транзиентным дефицитом были описаны патогенные генетические варианты в гене SERPINC1. Наиболее распространенными оказались варианты Cambridge II (p.Ala416Ser) и Dublin (p.Val30Glu). В клинической картине у таких пациентов были описаны случаи ВТЭО. Однако, как правило, проявления встречались реже, с более поздней манифестацией и имели более высокий процент артериальных тромбозов по сравнению с конститутивной недостаточностью. Авторы предложили два механизма, которые могут объяснять причину транзиентного дефицита: ограничения чувствительности и специфичности используемых функциональных методов и влияние внешних факторов. Авторы приходят к выводу о целесообразности проведения молекулярного скрининга в случаях с изменяющимися лабораторными показателями [23].
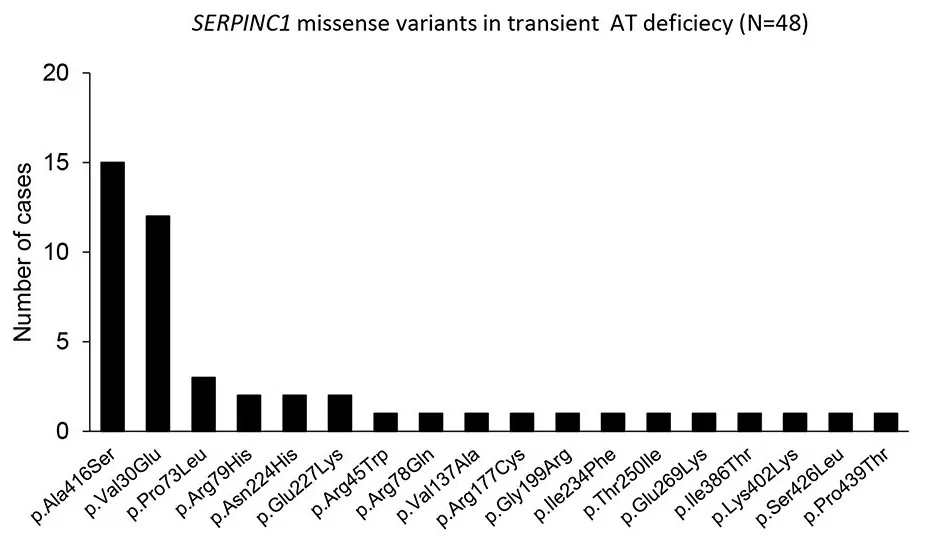
Рисунок 13. Частота встречаемости генетических вариантов, описанных у пациентов с транзиентной недостаточностью. По данным литературы [23].
Выводы
Диагностика наследственных тромбофилий является важным этапом не только при постановке корректного диагноза, но и играет роль в последующем назначении лекарственной терапии и профилактики. Однако, лабораторная диагностика, основанная на рутинных методах иммунологии и биохимии, имеет ряд ограничений. К ограничениям относят сложность соблюдения преаналитических условий исследования и невысокий процент чувствительности используемых рутинных тестов исследований. Также к недостаткам относят невозможность по разным причинам классифицировать все виды и подвиды дефицитов недостаточности протеина С, протеина S и антитромбина. Молекулярный анализ же способен разрешить ряд вышеперечисленных проблем, способствовать более чувствительной и специфичной диагностике наследственных тромбофилий.
При этом стоит отметить, что клинический фенотип пациента не всегда зависит только от типа дефицита, влияние могут оказывать и другие факторы (например, хирургическое вмешательство). Комплексная же диагностика на основе биохимических, иммунологических и генетических методах исследования позволит повысить выявляемость данных заболеваний и принимать более индивидуальные решения для лечения и профилактики пациентов. Помимо этого, такая стратегия будет способствовать прогнозированию риска развития ВТЭО в последующих поколениях.
1. Dinarvand P., Moser K. A. Protein C deficiency //Archives of Pathology & Laboratory Medicine. – 2019. – Т. 143. – №. 10. – С. 1281-1285.
2. Barbitoff YA, Khmelkova DN, Pomerantseva EA, Slepchenkov AV, Zubashenko NA, Mironova IV, et al. (2021) Expanding the Russian allele frequency reference via cross-laboratory data integration: insights from 6,096 exome samples
3. Winther-Larsen A. et al. Protein C deficiency; PROC gene variants in a Danish population //Thrombosis research. – 2020. – Т. 185. – С. 153-159.
4. Alhenc-Gelas M. et al. Genotype–Phenotype Relationships in a Large French Cohort of Subjects with Inherited Protein C Deficiency //Thrombosis and Haemostasis. – 2020. – Т. 120. – №. 09. – С. 1270-1281.
5. Croles F. N. et al. Pregnancy, thrombophilia, and the risk of a first venous thrombosis: systematic review and bayesian meta-analysis //Bmj. – 2017. – Т. 359.
6. Gupta A. et al. Protein S deficiency //StatPearls [Internet]. – StatPearls Publishing, 2022.
7. Cooper P. C. et al. Recommendations for clinical laboratory testing for protein C deficiency, for the subcommittee on plasma coagulation inhibitors of the ISTH //Journal of Thrombosis and Haemostasis. – 2020. – Т. 18. – №. 2. – С. 271-277.
8. Labrouche S. et al. Protein C and protein S assessment in hospital laboratories: which strategy and what role for DNA sequencing? //Blood coagulation & fibrinolysis. – 2003. – Т. 14. – №. 6. – С. 531-538.
9. Caspers M. et al. Deficiencies of antithrombin, protein C and protein S–practical experience in genetic analysis of a large patient cohort //Thrombosis and haemostasis. – 2012. – Т. 108. – №. 08. – С. 247-257.
10. Chan N, Cheng C, Chan K, Wong C, Lau K, Kwong J, et al. Distinctive regional-specific PROS1 mutation spectrum in southern China. J Thromb Thrombolysis. 2018;46:120–4.
11. Wypasek E, Potaczek DP, Plonka J, Alhenc-Gelas M, Undas A. Protein S deficiency and Heerlen polymorphism in a polish patient with acute myocardial infarction and previous venous thromboembolism. Thromb Res. 2013;132:776–7.
12. Pintao M. C. et al. Gross deletions/duplications in PROS1 are relatively common in point mutation-negative hereditary protein S deficiency //Human genetics. – 2009. – Т. 126. – С. 449-456.
13. Zhang Y. et al. A thrombophilia family with protein S deficiency due to protein translation disorders caused by a Leu607Ser heterozygous mutation in PROS1 //Thrombosis Journal. – 2021. – Т. 19. – С. 1-11
15. Xu J., Peng G., Ouyang Y. A novel mutation Gly222Arg in PROS1 causing protein S deficiency in a patient with pulmonary embolism //Journal of Clinical Laboratory Analysis. – 2020. – Т. 34. – №. 4. – С. e23111.
16. Gupta A. et al. Protein S deficiency //StatPearls [Internet]. – StatPearls Publishing, 2022.
17. Fenclova T. et al. The impact of PROS1 mutation position on thrombotic risk in protein S–deficient patients //Research and Practice in Thrombosis and Haemostasis. – 2023. – Т. 7. – №. 4. – С. 100194.
18. Rezaie A. R., Giri H. Anticoagulant and signaling functions of antithrombin //Journal of Thrombosis and Haemostasis. – 2020. – Т. 18. – №. 12. – С. 3142-3153.
19. Corral J., de la Morena-Barrio M. E., Vicente V. The genetics of antithrombin //Thrombosis research. – 2018. – Т. 169. – С. 23-29.
20. Picard V. et al. Molecular bases of antithrombin deficiency: twenty‐two novel mutations in the antithrombin gene //Human mutation. – 2006. – Т. 27. – №. 6. – С. 600-600.
21. Mulder R. et al. SERPINC 1 gene mutations in antithrombin deficiency //British Journal of Haematology. – 2017. – Т. 178. – №. 2. – С. 279-285.
22. Van Cott E. M. et al. Recommendations for clinical laboratory testing for antithrombin deficiency; communication from the SSC of the ISTH //Journal of Thrombosis and Haemostasis. – 2020. – Т. 18. – №. 1. – С. 17-22.
23. Bravo‐Pérez C. et al. Molecular and clinical characterization of transient antithrombin deficiency: a new concept in congenital thrombophilia //American Journal of Hematology. – 2022. – Т. 97. – №. 2. – С. 216-225.
24. Лобастов К. В., Дементьева Г. И., Лаберко Л. А. Современные представления об этиологии и патогенезе венозного тромбоза: переосмысление триады Вирхова //Flebologia. – 2019. – Т. 13. – №. 3.
25. Васильев С. А. и др. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика //Русский медицинский журнал. Медицинское обозрение. – 2013. – Т. 21. – №. 17. – С. 896-901.
26. Андрияшкин А. В. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) //Флебология. – 2015. – Т. 2. – №. 4. – С. 2.
27. Wypasek E. et al. Genetic characterization of antithrombin, protein C and protein S deficiencies in Polish patients //Polskie Archiwum Medycyny Wewnętrznej= Polish Archives of Internal Medicine. – 2017. – Т. 127. – №. 7-8.
28. Deng M. et al. Two novel compound heterozygous mutations associated with types I and II protein C deficiency with unusual phenotypes //Thrombosis Research. – 2016. – Т. 145. – С. 93-99.
29. Li L. et al. Clinical manifestation and mutation spectrum of 53 unrelated pedigrees with protein S deficiency in China //Thrombosis and Haemostasis. – 2019. – Т. 119. – №. 03. – С. 449-460.
30. Larsen O. H. et al. Genetic Variants in the Protein S (PROS1) Gene and Protein S Deficiency in a Danish Population //TH Open. – 2021. – Т. 5. – №. 04. – С. e479-e488.
31. Huang J. et al. A new hereditary PROS1 mutation caused isolated cortical venous thrombosis: a case report and literature review. – 2022.
32. Baker P. et al. Guidelines on the laboratory aspects of assays used in haemostasis and thrombosis //British journal of haematology. – 2020. – Т. 191. – №. 3. – С. 347-362.