Первичный склерозирующий холангит
Определение
Первичный склерозирующий холангит (ПСХ) – идиопатическое хроническое холестатическое, непрерывно прогрессирующее аутоиммунное заболевание печени, характеризующееся воспалением, облитерирующим фиброзом и сегментарной дилатацией внутри- и внепеченочных желчных протоков, приводящими к формированию мультифокальных билиарных стриктур и развитию вторичного билиарного цирроза печени, портальной гипертензии и печеночной недостаточности. Важной особенностью этого заболевания является частое сочетание с воспалительными заболеваниями кишечника (ВЗК). До 70% больных с ПСХ страдают ВЗК.
Помимо первичного склерозирующего холангита, в группу аутоиммунных заболеваний печени также входят аутоиммунный гепатит (АИГ), первичный билиарный холангит (ПБХ) и перекрестные синдромы.
История изучения вопроса
ПСХ впервые был описан французскими хирургами P. Delbet (1924 г.) и R. Lafourcade (1925 г.). Термин «первичный склерозирующий холангит» стал использоваться с 1964 г. с целью дифференциальной диагностики с вторичным холангитом. Долгое время этот диагноз устанавливался на основании аутопсии, и заболевание считалось крайне редким. К концу 1970-х годов в мировой литературе было описано лишь около 100 случаев ПСХ. Рост выявления ПСХ начался с 1990-х г.г. после широкого введения в клиническую практику визуализирующих методов исследования билиарного дерева, таких как эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) и магнитно-резонансная холангиопанкреатография (МРХПГ).
История изучения сочетанной патологии ПСХ и ВЗК началась в 1874 г., когда C. H. Thomas впервые описал изъязвления в толстой кишке у пациента, умершего от неустановленного заболевания печени. В 1899 г. J. D. Lister опубликовал случай вторичного диффузного гепатита у пациента с язвенным колитом (ЯК). В дальнейшем J. A. Bargen (1929) и H. J. Tumen с соавт. (1947) описали цирроз в исходе неуточненного заболевания печени, сочетающегося с ЯК. И только в 1958 г. R.W. Boden с соавт. впервые предположили наличие холестатического поражения печени при ЯК на основании выявления у пациентов повышения активности сывороточной ЩФ. А уже в 1964 г. A. J. Atkinson и W. W. Carroll впервые описали ПСХ как причину поражения печени при ВЗК. Несмотря на наличие несомненной ассоциации между ПСХ и ВЗК, до конца 60-х гг. XX в. имелись лишь единичные описания сочетанных заболеваний, что объяснялось крайне редким выявлением ПСХ.
Эпидемиология
В настоящее время заболеваемость ПСХ в разных странах находится в пределах от 0,95 до 1,3 на 100 тыс. жителей в год, распространенность – от 0 до 16,2 на 100 тыс. жителей. В клинических рекомендациях Американской коллегии гастроэнтерологов (ACG, 2015), а также совместных рекомендациях Европейского общества гастроинтестинальной эндоскопии (ESGE) и Европейской ассоциации по изучению печени (EASL, 2017) подчеркивается, что, вероятно, истинная распространенность ПСХ гораздо выше. По мнению экспертов, зачастую это обусловлено бессимптомным течением заболевания, а также малой настороженностью практикующих врачей в отношении данной нозологии. В подтверждение этому в рекомендациях ESGE/EASL (2017 г.) приводятся данные о росте в 4 раза частоты выявления ПСХ при выполнении МРХПГ у пациентов с язвенным колитом (ЯК) без клинических и лабораторных признаков холестаза. Распространенность и заболеваемость ПСХ в РФ точно не установлены: эпидемиологические исследования не проводились, в литературе имеются единичные публикации клинических случаев и исследований на малых популяционных выборках.
Соотношение мужчины/женщины среди пациентов ПСХ в среднем составляет 2:1, хотя в последние годы зарегистрирован рост частоты выявления ПСХ среди женщин. Обычно ПСХ диагностируют в возрасте в 35–51 год (в среднем в 40 лет), хотя диагноз может быть установлен и в детском и старческом возрасте.
Принято отдельно выделять ПСХ мелких протоков, при котором имеются типичные для ПСХ признаки холестаза и гистологическая картина, но отсутствуют характерные изменения крупных желчных протоков при холангиографии. Данные о распространенности и заболеваемости этого варианта ПСХ ограничены. Предположительно, заболеваемость ПСХ мелких протоков составляет 0,15 на 100 000 жителей в год.
Частота выявления ВЗК при ПСХ составляет по разным данным 20–98% (в среднем, около 70%). ВЗК при ПСХ имеет ряд клинико-морфологических особенностей, отличающих его от классических форм ЯК и болезни Крона (БК). Это затрудняет дифференциальную диагностику ВЗК, сочетающихся с ПСХ. Тем не менее, большинство исследователей не считают целесообразным выделение ВЗК при ПСХ в отдельную нозологическую форму.
Этиопатогенез
Этиология и патогенез ПСХ неизвестны. По результатам крупномасштабных генетических исследований установлена прочная ассоциация заболевания с определенными подтипами HLA (прежде всего, гаплотипами DRВ1*1301, DQA1*0103, DQВ1*0603). В крупном генетическом исследовании M. Harbord с соавт. (2015) [4,7] было идентифицировано 12 не-HLA генов, ассоциированных с риском развития ПСХ. Другими возможными причинами развития ПСХ считают аберрации в гене, кодирующем белок множественной лекарственной устойчивости 3 (MDR3), и обусловленную дефектами лигандов молекулы адгезии MAdCAM-1 миграцию в желчные протоки лимфоцитов, активированных в кишечнике.
Частое сочетание ПСХ и ВЗК указывает на возможную роль кишечной микрофлоры в патогенезе ПСХ. Гипотеза «повышенной кишечной проницаемости» в настоящее время представляется наиболее вероятной в развитии сочетанной патологии ПСХ и ВЗК. Согласно ей, ведущую роль в патогенезе ПСХ играет транслокация бактерий и их токсинов через поврежденную стенку толстой кишки в кровь, это приводит к увеличению энтерогепатической циркуляции «патоген-ассоциированных молекулярных образцов». Выявление атипичных рANCA (отличающихся от ANCA при васкулитах), вероятно, также служит доказательством гипотезы «повышенной кишечной проницаемости» патогенеза ПСХ. Атипичные рANCA, возможно, направлены против человеческого β-тубулина изотипа-5, который перекрестно реагирует с белком деления бактериальной клетки FtsZ. Их выявление, по-видимому, отражает аберрации иммунного ответа на кишечные микроорганизмы у предрасположенных лиц.
Вероятнее всего, патогенез ПСХ – процесс многофакторный. Развитие заболевания происходит у генетически предрасположенных лиц под воздействием триггеров, инициирующих запуск сложных процессов взаимодействия между врожденным и приобретенным иммунитетом, которые в конечном счете приводят к миграции лимфоцитов, повреждению холангиоцитов и прогрессирующему фиброзу.
Классификация
ПСХ относят к группе аутоиммунных заболеваний печени (АИЗП), в которую также входят аутоиммунный гепатит (АИГ), первичный билиарный холангит (цирроз) – ПБХ(Ц), а также «перекрестные синдромы» (АИГ-ПБХ и ПСХ-АИГ). Последние представляют собой отдельную терминологическую и лечебно-диагностическую проблему. Перекрестный синдром ПСХ-АИГ будет рассмотрен ниже.
Общепринятой классификации ПСХ не существует, хотя попытки ее разработать предпринимались неоднократно. В последние годы принято отдельно выделять ПСХ мелких протоков, при котором имеются типичные для ПСХ лабораторные признаки холестаза и гистологическая картина заболевания, но отсутствуют характерные изменения крупных желчных протоков при холангиографии. Некоторые авторы классифицируют ПСХ по наличию ассоциации с ВЗК: а) ассоциированные с ВЗК; б) не ассоциированные с ВЗК.
В Российском консенсусе по диагностике и лечению первичного склерозирующего холангита (2018) [3] предложено проводить классификацию заболевания по фенотипу, в зависимости от:
-
возраста манифестации (дети, взрослые, пожилые люди);
-
cтепени вовлеченности желчных протоков (ПСХ крупных протоков; ПСХ внепеченочных протоков; ПСХ внутрипеченочных протоков; сочетание ПСХ внутри- и внепеченочных протоков; ПСХ с доминантной стриктурой и ПСХ мелких протоков);
-
уровня IgG4 (нормальный уровень IgG4; 1–2 ВПН; >2 ВПН);
-
расовой и этнической принадлежности пациента;
-
наличия и нозологической формы ВЗК (ЯК,БК, неуточненный колит; колит без клинических проявлений).
Предполагается, что фенотипы ПСХ различаются клинической картиной, частотой рецидивов, ответом на терапию, темпами прогрессирования заболевания, рисками смерти и необходимостью в трансплантации печени.
Клиническая картина
Клиническая картина ПСХ характеризуется многообразием форм. В дебюте заболевания клинические проявления отсутствуют у половины пациентов. Иногда больных беспокоят неспецифические признаки, такие как общая слабость, утомляемость, боль (или дискомфорт) в правом подреберье, эпизоды лихорадки, потеря массы тела. Длительный бессимптомный период обусловливает позднюю диагностику заболевания на далеко зашедших стадиях и, как следствие, ухудшает прогноз. При осмотре у пациентов с ПСХ чаще всего выявляется гепато- и спленомегалия.
Наиболее часто появление клинических признаков ПСХ обусловлено уже развитием осложнений заболевания, таких, как холестаз, стриктуры, дилатация желчных протоков, бактериальный холангит, цирроз.
Осложнения ПСХ условно можно разделить на 5 групп:
1. Возникшие вследствие поражения протоков: стриктуры, в том числе доминирующая стриктура (стеноз менее 1,5 мм в диаметре в общем желчном протоке и менее 1 мм в правом и левом печеночном протоках). Приводят к усилению холестаза (наиболее частый лабораторный синдром) и развитию механической желтухи.
2. Осложнения длительного холестаза: стеаторея, дефицит жирорастворимых витаминов, остеопороз, белково-энергетическая недостаточность.
3. Проявления и осложнения цирроза печени: слабость, портальная гипертензия (в том числе асцит, кровотечения из варикозно-расширенных вен пищевода, спонтанный бактериальный перитонит), печеночная энцефалопатия и др. Примерно в 5% случаев ПСХ диагностируется только на стадии цирроза.
4. Специфичные инфекционные осложнения – бактериальные холангиты (обычно при формировании доминирующей стриктуры).
5. Малигнизация – холангиоцеллюлярная карцинома (ХЦК), карцинома толстой кишки и др.
Пациенты с ПСХ и их родственники имеют более высокий риск развития внепеченочных аутоиммунных заболеваний. Наиболее часто при ПСХ встречаются: воспалительные заболевания кишечника, целиакия, саркоидоз, васкулиты, системная красная волчанка, синдром Шегрена, аутоиммунный гепатит, ревматоидный артрит, аутоиммунный тиреоидит.
В связи с частым сочетанием ПСХ с ВЗК, именно кишечная симптоматика зачастую сопутствует дебюту и течению заболевания печени (см. ниже).
Течение ПСХ постоянно прогрессирующее, 10-летняя выживаемость пациентов составляет 65%, а средняя продолжительность жизни с момента постановки диагноза составляет от 9 до 18 лет. При этом отмечаются значительные индивидуальные вариации, обусловленные в ряде случаев диагностикой заболевания только на терминальном его этапе. Показано, что выживаемость при ПСХ значительно выше у бессимптомных пациентов, хотя, по другим данным, наличие симптомов не является прогностически значимым фактором.
Не вызывает сомнения повышенная частота развития неопластических заболеваний при ПСХ. ХЦК осложняет течение ПСХ у 4–36% пациентов. Она может диагностироваться на любой стадии ПСХ, примерно в половине случаев ХЦК выявляется в течение первого года после постановки диагноза ПСХ. Колоректальный рак (КРР) обнаруживается у 22% пациентов с ПСХ и является вторым по частоте встречаемости онкологическим осложнением ПСХ. Кроме того, пациенты с ПСХ, в сравнении с общей популяцией, имеют повышенный риск развития рака поджелудочной железы, а также злокачественных новообразований других локализаций.
Диагностика
Сложности в диагностике ПСХ определяются длительным бессимптомным течением, отсутствием патогномоничных клинических признаков и специфичных аутоантител. Не существует абсолютных диагностических критериев ПСХ, диагноз устанавливается путем исключения вторичных причин холестаза и выявления совокупности определенных признаков.
1. Лабораторная диагностика
Наиболее характерным лабораторным синдромом при ПСХ является холестатический: повышение активности щелочной фосфатазы (ЩФ), γ-глутамилтрансферазы (ГГТП). Тем не менее нормальный уровень ЩФ не исключает наличия заболевания . У некоторых пациентов отмечается повышение активности сывороточных аминотрансфераз в 2–3 раза от ВПН, но также может находиться в пределах референтных значений. Повышение активности трансаминаз более чем в 5 раз от ВПН рассматривается как признак АИГ. В период постановки диагноза уровень билирубина в сыворотке крови в норме у 70% пациентов, но с прогрессированием заболевания отмечается его нарастание.
Для исключения перекрестного синдрома ACG (2015 г.) рекомендует выполнение МРХПГ всем пациентам с АИГ младше 25 лет с повышением ЩФ в 2 и более раз от ВПН и выполнение биопсии печени всем пациентам с ПСХ с повышением аминотрансфераз в 5 и более раз от ВПН. Уровни сывороточных билирубина и альбумина в период постановки диагноза находятся в пределах референтных значений у 70% пациентов, хотя с течением заболевания может отмечаться их изменение.
Содержание сывороточного иммуноглобулина G (IgG) повышено примерно у 60% пациентов, иммуноглобулина М (IgM) – у 50%. До 22% пациентов с ПСХ имеют повышение IgG4. При повышении IgG4 необходимо проведение дифференциальной диагностики с IgG4-связанным склерозирующим холангитом. Клиническое значение этого маркера в настоящий момент уточняется. Есть данные о том, что ПСХ, сопровождающийся повышением IgG4, как правило, имеет быстро прогрессирующее течение и, в отличие от IgG4-связанного заболевания, не отвечает на терапию глюкокортикостероидами [1]. Согласно другим данным [3], по клиническим проявлениям течение IgG4-СХ и ПСХ практически неразличимо. Тем не менее, согласно рекомендациям ACG, всем пациентам с установленным диагнозом ПСХ хотя бы однократно необходимо определение уровня IgG4.
В отличие от других АИЗП для ПСХ не существует патогномоничных аутоантител, хотя могут выявляться разные их виды. В рекомендациях EASL (2009 г.), Российской гастроэнтерологической ассоциации (РГА, 2015), ACG (2015 г.) уточняется, что для установления диагноза ПСХ рутинный скрининг антител не требуется.
Наиболее часто, в 35–95% случаев (в среднем, 63%), при ПСХ определяются атипичные антинейтрофильные цитоплазматические антитела (p-ANCA), однако их роль не определена окончательно. В одном из исследований агтипичные АНЦА (аАНЦА, xANCA) были охарактеризованы как диагностически значимый биомаркер ПСХ. АНЦА выявлялись в желчи больных с ПСХ достоверно чаще (38%), чем у больных без ПСХ (6%) и были ассоциированы с десятикратным повышением риска ПСХ. Обнаружение АНЦА в желчи коррелировало с более тяжелым поражением желчных путей и последующим количеством вмешательств. В других исследованиях было показано, что позитивность по аАНЦА при ПСХ ассоциирована с желчными камнями и холангиокарциномой, более обширным поражением желчных путей и трансплантацией печени. В недавнем норвежском исследовании АНЦА были обнаружены у 80% пациентов с ПСХ, пАНЦА – у 70%. Эти АНЦА-позитивные пациенты были моложе на момент постановки диагноза, и у них был более низкий риск развития билиарного рака, но ассоциации с ВЗК не было. Частота развития билиарного рака в значительно большей степени была ассоциирована с возрастом на момент постановки диагноза, нежели с АНЦА-статусом. Тем не менее, экспертный совет считает, что данных в пользу прогностической значимости аАНЦА-позитивности при ПСХ недостаточно [12].
Антинуклеарные антитела (ANA) и антигладкомышечные антитела (ASMA) выявляются при ПСХ в 8–77% и 0–83% случаев соответственно. Стоит отметить, что специфичные для ПБХ(Ц) антимитохондриальные антитела (АМА) не характерны для ПСХ. В связи с этим в рекомендациях ACG (2015 г.) отмечена необходимость определения АМА при подозрении на ПСХ с целью дифференциации ПБХ(Ц).
Согласно Консенсусу по внекишечным проявлениям ВЗК Европейской организации болезни Крона и колита (ECCO, 2016) особое внимание в скрининге ПСХ должно быть уделено пациентам с установленным диагнозом ВЗК. По мнению экспертов, всем пациентам с ВЗК необходим мониторинг биохимических маркеров холестаза, даже при отсутствии клинических признаков манифестации ПСХ. При выявлении лабораторных маркеров холестаза показано исследование билиарного дерева, независимо от наличия клинической картины ПСХ. При этом должны быть исключены причины вторичного холестаза.
2. Холангиография
Холангиография – ведущий метод диагностики ПСХ, она показана всем пациентам с подозрением на заболевание.
МРХПГ рекомендуется ведущими гепатологическими ассоциациями как способ неинвазивной визуализации 1-й линии, назначаемый при подозрении на ПСХ.
ЭРХПГ, долгое время считавшаяся «золотым стандартом» в диагностике ПСХ, является инвазивной методикой и связана с высоким риском развития осложнений, таких как панкреатит и сепсис. Поэтому ее выполнение, согласно рекомендациям РГА (2015 г.), ACG (2015 г.), ESGE/EASL (2017 г.), показано при одновременном проведении лечебно-диагностических процедур (забор гистологического материала из протоков, установка стентов в протоки и др.) либо неинформативности МРХПГ или наличии противопоказаний к ее выполнению. Предполагаемая польза от выполнения ЭРХПГ должна превышать потенциальные риски от ее проведения.
При ПСХ чаще поражены внутри- и внепеченочные желчные протоки. Изолированное поражение внутрипеченочных желчных протоков встречается в 25% случаев.
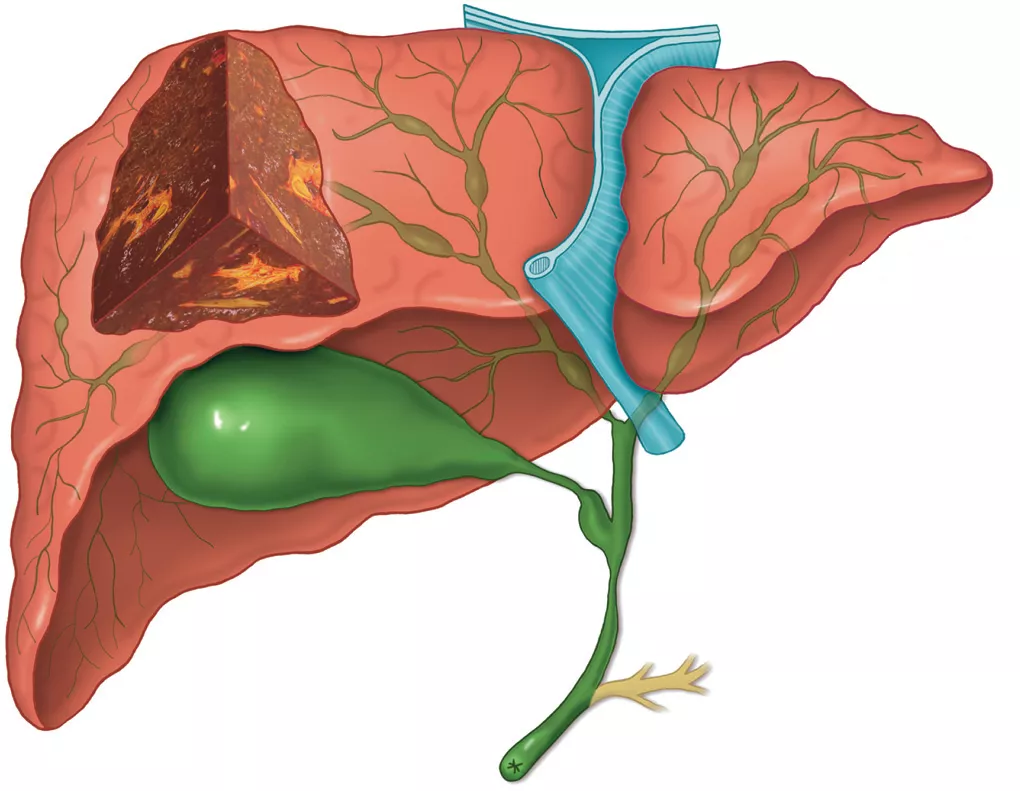
Рисунок 1. Патологические изменения желчевыводящих путей при первичном склерозирующем холангите (макроскопические изменения) [5].
Наблюдается множество стриктур с мешковидными расширениями как внутрипеченочных, так и внепеченочных желчных протоков, что являются типичной холангиографической картиной. Стриктуры приводят к регионарному холестазу, очаговому перибилиарному фиброзу и в конечном итоге к холестатическому циррозу печени. Изолированное внутрипеченочное поражение встречается у 30% пациентов, а изолированное внепеченочное поражение встречается редко. Почти у 90% пациентов наблюдается аномалии желчного пузыря, а камни в желчных протоках обнаруживаются у 25% пациентов.

Рисунок 2. Стриктура холедоха (по данным МРХПГ)[1]
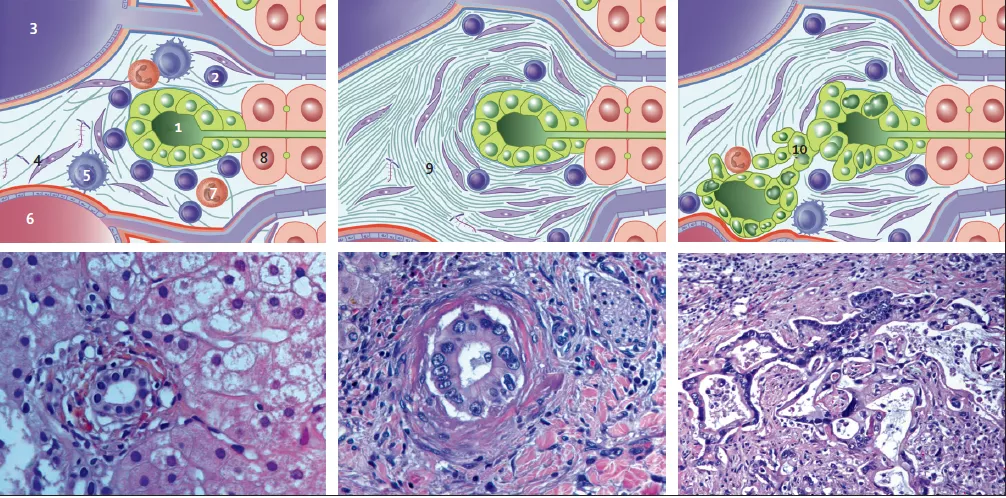
Рисунок 3. Патологические изменения желчевыводящих путей при первичном склерозирующем холангите (микроскопические изменения) [5]. Развернуть на весь экран.
На ранних стадиях заболевания (слева) выявляются минимальные изменения эпителия желчных протоков с инфильтрацией окружающих тканей лимфоцитами. Типичное поражение (в середине) представляет собой облитерирующий, негнойный холангит со значительным перидуктульным фиброзом в виде «луковых колец» и отмечается менее чем в 20% биопсий. На поздних стадиях (справа) возникаю диспластические изменения с возможным развитием холангиокарциномы. Дисплазия может быть многоочаговой и вовлекать желчный пузырь. 1– желчный проток, 2 –лимфоциты, 3 – воротная вена, 4 – фибробласт, 5 – макрофаг, 7 – нейтрофил, 6 – артерия, 8 – гепатоцит, 9 – коллаген, 10 – холангиокарцинома.
3. Биопсия печени
Эксперты EASL (2009 г.), AСG (2015 г.), РГА (2015 г.) сходятся во мнении, что проведение биопсии печени для установления диагноза при типичной холангиограмме необязательно, поскольку патогномоничные признаки ПСХ в биоптате обнаруживаются достаточно редко. В то же время в рекомендациях EASL (2009 г.), РГА (2015 г.) указано, что данные биопсии, в случае ее выполнения, помогают оценить активность и стадию заболевания. Проведение биопсии печени показано при нормальных холангиограммах и подозрении на ПСХ мелких протоков. Также при значительном повышении аминотрансфераз биопсия печени позволяет диагностировать перекрестный синдром с АИГ. Кроме того, биопсия показана для исключения IgG4-связанного склерозирующего холангита.
Диагностиечкие критерии
Японские диагностические критерии первичного склерозирующего холангита 2016 г. [8]
Прежде всего необходимо исключить IgG4-связанный склерозирующий холангит*, вторичный склерозирующий холангит и злокачественные новообразования печени и желчных протоков.
I. Большие критерии
A. Исследования желчевыводящих путей
1) Холангиографические данные, подтверждающие ПСХ
2) Холангиографические данные, неспецифичные для ПСХ
B. Повышение уровня щелочной фосфатазы
II. Малые критерии
a. Ассоциированность с воспалительными заболеваниями кишечника
b. Гистология печени (биопсия): фиброзный холангит / поражение по типу «луковых колец»
|
A1) +B |
диагноз подтверждён |
|
A1) +a |
диагноз подтверждён |
|
A1) +b |
диагноз подтверждён |
|
|
|
|
A1) |
диагноз вероятен |
|
|
|
|
A2) +B+a+b |
диагноз подтверждён |
|
A2) +B+a |
диагноз вероятен |
|
A2) +B+b |
диагноз вероятен |
|
|
|
|
A2) +a+b |
диагноз вероятен |
|
A2) +a |
диагноз возможен |
|
A2) +b |
диагноз возможен |
* Диагноз IgG4-связанный склерозирующий холангит может быть установлен на основании японских диагностических критериев 2012 г [9].
Причины вторичного слкрозирующего холангита (должны быть исключены при постановке диагноза ПСХ) [8]:
|
Врожденные заболевания |
Болезнь Кароли (дефект гена PKHD1) |
|
Холангиопатия, связанная с дефектом ABCB4 |
|
|
Хроническая обструкция |
Холедохолитиаз |
|
Опухоли |
|
|
Билиарные стириктуры (после хирургического вмешательства, хронического панкреатита) |
|
|
Стриктуры анастамоза после трансплантации печени |
|
|
Инфекции |
Бактериальный холангит, рецидивирующий гнойный холангит |
|
Паразитарные инфекции (криптоспоридиоз, микроспоридиоз) |
|
|
ЦМВ-инфекция |
|
|
Токсическое воздействие |
Алкоголь, формальдегид, гипертонический солевой р-р |
|
Иммунологические причины |
Эозинофильный холангит |
|
Первичный билиарный холангит (цирроз) |
|
|
Врожденный или приобретенный иммунодефицит |
|
|
Ишемические причины |
Травма сосудов |
|
Посттравматический склерозирующий холангит |
|
|
Посттрансплантационный тромбоз печеночной артерии |
|
|
Отторжение трансплантата печени |
|
|
Интраартериальное повреждение, связанное с химиотерапией |
|
|
Транскатетерная артериальная эмболизация |
|
|
Инфильтративные заболевания |
|
|
Радиационное повреждение |
|
|
Гиперэозинофильный синдром |
|
|
Лимфома Ходжкина |
Перекрестный синдром первичный склерозирующий холангит / аутоиммунный гепатит (ПСХ/АИГ)
Перекрестный синдром ПСХ/АИГ выявляется у 1,4–17% пациентов с АИГ. Сочетание АИГ и ПСХ описано и у детей, и у взрослых. Предполагается, что такая комбинация наблюдается у значительной части пациентов молодого возраста с аутоиммунным поражением печени. Описаны единичные случаи перекрестного синдрома ПСХ/ПБХ. Под термином «перекрестный синдром ПСХ/АИГ», согласно рекомендациям EASL (2009 г.), понимают нечетко определенные иммунные расстройства с характерными гистологическими особенностями АИГ и типичными холангиографическими признаками ПСХ (признаки ПСХ крупного билиарного протока), отсутствием антимитохондриальных антител АМА. Это определение не учитывает возможность сочетания АИГ с ПСХ мелких протоков.
В 2011 г. Международной рабочей группой по аутоиммунному гепатиту (IAIHG) предложено классифицировать АИЗП только по основным диагнозам – АИГ, ПБХ и ПСХ или ПСХ мелких протоков, при этом последние могут протекать с признаками АИГ. То есть, согласно рекомендациям IAIHG, в случае перекрестного синдрома диагноз формулируется как ПСХ с признаками АИГ. Такая номенклатура призвана упростить для клиницистов процесс постановки и формулировки диагноза.
Следует отметить, что почти у половины детей с АИГ описана особая нозологическая форма, характеризующаяся как наличием проявлений АИГ, так и склерозирующего холангита. На этом основании Mieli-Vergani и соавторы ввели термин «аутоиммунный склерозирующий холангит» (АСХ), указывающий на необходимость исследования состояния билиарного дерева, по крайней мере с помощью МРХПГ, у всех детей с диагнозом АИГ. В настоящее время считается, что этот вариант наблюдается только у детей, поскольку результаты проспективного исследования у взрослых с АИГ дали отрицательный результат. Поэтому если АИГ развился в зрелом возрасте, то в отсутствие признаков холестаза проводить МРХПГ нецелесообразно. Однако МРХПГ рекомендуется выполнять практически всем молодым взрослым с АИГ и проявлениями холестаза, а также пациентам с АИГ с продолжающимся холестазом (даже при условии адекватной иммуносупрессии) с целью выявить ПСХ как основное или сопутствующее заболевание.
У пациентов с лабораторными признаками холестаза, отсутствием АМА, гистологическими данными, свидетельствующими в пользу ПСХ или ПБХ и нормальными данными холангиографии, может быть ПСХ малых протоков или АМА-негативный ПБХ.
Согласно статистическим данным, у 42% пациентов с АИГ и сопутствующим ЯК имеют холангиографические изменения, типичные для ПСХ. ЯК присутствует у 45% детей с перекрестным синдромом ПСХ-АИГ. Т.о., диагноз перекрестного синдрома ПСХ-АИГ следует подозревать у всех пациентов с АИГ и сопутствующим хроническим ЯК, необъяснимыми признаками холестаза или отсутствием ответа на стандартную терапию глюкокортикоидами.
Первичный склерозирующий холангит мелких протоков
Под термином «ПСХ мелких протоков» понимают особую форму ПСХ, при которой имеются типичные для ПСХ клинико-лабораторные признаки и гистологическая картина, но при холангиографии отсутствуют изменения крупных желчных протоков. Эту форму выявляют у 3,6–28% пациентов с ПСХ. Предположительно, заболеваемость ПСХ мелких протоков составляет 0,15 на 100 000 жителей в год. На сегодняшний день доподлинно не установлено, является ли ПСХ мелких протоков ранней стадией, вариантом легкого течения классической формы ПСХ или представляет собой отдельное заболевание [2].
Предположение о том, что ПСХ мелких протоков является ранней стадией классической формы ПСХ косвенно подтверждаются данными ряда работ, демонстрирующих развитие поражения крупных протоков у четверти пациентов с ПСХ мелких протоков в среднем через 8 лет после постановки диагноза. В пользу гипотезы отдельной нозологической формы свидетельствуют результаты недавно проведенного генетического исследования. В нем выявлены ассоциации ПСХ мелких протоков/ВЗК и классического ПСХ с геном HLA-B*08, а ПСХ мелких протоков без ВЗК — с HLA-DRB1*13:01 [2].
В настоящее время отсутствуют общепринятые критерии постановки диагноза ПСХ мелких протоков. Согласно рекомендациям ряда гепатологических и гастроэнтерологических ассоциаций, диагноз устанавливается при выявлении типичных признаков ПСХ при морфологическом исследовании биоптатов печени в отсутствие холангиографических изменений.
Несмотря на ранее опубликованные данные об обязательном сочетании ПСХ мелких протоков с ВЗК, сейчас считается, что отсутствие ВЗК не исключает ПСХ мелких протоков. Данные о частоте выявления ВЗК при ПСХ мелких протоков неоднозначны. В исследовании U. Broomé с соавт. (2002) в когорте пациентов из Швеции не выявлено строгой ассоциации ПСХ мелких протоков с ВЗК. В то же время в североамериканских работах ВЗК обнаруживались у 50–88% пациентов с ПСХ мелких протоков. Отдельные работы указывают, что ПСХ мелких протоков чаще сочетается с БК (22%), чем с ЯК (6%) [2].
Воспалительные заболевания кишечника и первичный склерозирующий холангит
Важной особенностью ПСХ является частое сочетание с воспалительными заболеваниями кишечника (ВЗК), к которым относятся язвенный колит (ЯК) и болезнь Крона (БК). Частота выявления ВЗК при ПСХ составляет по разным данным 20–98% (в среднем, около 70%).
Чаще всего наблюдается сочетание ПСХ с ЯК (44,2–97,6% от всех случаев ВЗК). Диагноз БК устанавливается у 2,4–52,8% пациентов, а ВЗКн (неклассифицируемое) — в 0–25,9% случаев [2]. Зачастую первоначальный диагноз ВЗКн с течением заболевания изменяется на ЯК или БК.
Напротив, ПСХ у пациентов с ВЗК встречается гораздо реже, он диагностируется только у 2,4–7,5% пациентов с ЯК и у 3,4% с БК. Однако вполне вероятно, что истинная распространенность ПСХ при ВЗК значительно выше, и недооценка частоты определяется плохой диагностикой бессимптомных форм заболевания печени. Так, в исследовании A. K. Lunder с соавт. (2016) после выполнения скрининговой МРХПГ 322 норвежским пациентам с ВЗК частота ПСХ повысилась с 2,2 до 8,1%. Интересно отметить, что у 65% этих пациентов полностью отсутствовали клинико-лабораторные признаки поражения печени.
Распространенность ВЗК при ПСХ в Российской Федерации мало изучена. Основываясь на единичных опубликованных результатах отечественных исследований на малых выборках, мы можем предположить, что в европейской части России ВЗК выявляется у 66,7% пациентов с ПСХ [2].
Ранее сообщалось, что дебют ВЗК в большинстве случаев предшествует манифестации ПСХ. Однако в последние годы зафиксирован рост манифестации сочетанной патологии с симптомами ПСХ. Вероятно, это обусловлено большей настороженностью врачей и улучшением методов диагностики ПСХ. Так, установлено, что при проведении в дебюте ВЗК скрининга (определении маркеров холестаза) у каждого пятого пациента выявлялись лабораторные признаки ПСХ [2].
Остается нерешенным и вопрос о влиянии ВЗК на течение и прогноз ПСХ. Это отчасти объясняется малой распространенностью изолированных форм ПСХ, затрудняющей проведение крупных исследований. Содержащиеся в мировой литературе сведения по данному вопросу ограничены и зачастую противоречивы. В большинстве работ авторы склоняются к мнению, что сочетание с ВЗК не оказывает влияния на течение и долгосрочный прогноз ПСХ. В то же время имеются данные, демонстрирующие, что наличие ВЗК обусловливает ранний дебют, более частое развитие онкологических осложнений, большую потребность в трансплантации печени и более высокую смертность среди пациентов с ПСХ. Именно поэтому в недавних работах S. Sarkar с соавт. (2016) и Е. В. Винницкой с соавт. (2018) выделяются отдельные фенотипические формы ПСХ — с и без ВЗК.
Дебют ВЗК при сочетании с ПСХ в большинстве случаев характеризуется полным отсутствием или малой выраженностью клинической симптоматики [2]. При наличии клинической картины основным проявлением дебюта ВЗК при ПСХ является диарея. Стул у пациентов с сочетанной патологией, в отличие от изолированной формы ЯК, незначительно учащен и только в половине случаев сопровождается примесью крови. У части пациентов наблюдаются малоинтенсивные боли в животе, иногда отмечаются жалобы на повышение температуры, снижение массы тела, общую слабость и повышенную утомляемость.
Течение ВЗК при ПСХ в 20–65% случаев характеризуется единственной атакой заболевания с длительным периодом ремиссии. Ремиттирующее течение заболевания наблюдается в среднем у 1/5 пациентов с ВЗК/ПСХ и отличается редкими атакам. Непрерывное течение ВЗК выявляют примерно у 10% пациентов с ПСХ.
К типичным симптомам, регистрируемым при ВЗК, сочетающимися с ПСХ, относят: послабление стула с примесью крови, дискомфорт в животе, повышение температуры, снижение массы тела. В отличие от классических форм ЯК, более половины пациентов с ЯК/ПСХ имеют легкое течение заболевания. Тяжесть течения БК/ПСХ, по данным большинства авторов, эквивалентна или чуть ниже, чем при изолированной форме заболевания. Перианальные поражения встречаются в среднем у 22% пациентов с БК/ПСХ, что сопоставимо с изолированной формой заболевания. Важно отметить, что тяжесть течения ВЗК не коррелирует с клинической и лабораторной активностью ПСХ.
При сочетании ВЗК с ПСХ pANCA выявляется у 25–85% пациентов. Повышенные титры pANCA наблюдаются как при изолированных типах ЯК, ПСХ, так и при их сочетанном течении. При БК/ПСХ pANCA также выявляются, хотя и несколько реже. Роль данных антител в патогенезе сочетанной патологии до конца не ясна. Не исключено, что pANCA лишь сопутствуют хроническому воспалению и не участвуют непосредственно в развитии ВЗК/ПСХ.
Таким образом, как и при изолированном течении ЯК, при ВЗК на фоне ПСХ клинико-лабораторных маркеров недостаточно для верификации диагноза, требуется выполнение эндоскопических исследований, основным из которых является колоноскопия.
Одна из основных эндоскопических особенностей ВЗК при ПСХ — преобладание тотального поражения толстой кишки. Распространенный колит выявляют у 35–95% пациентов с ЯК/ПСХ и 36,8–82,1% пациентов с БК/ПСХ. Остальные формы ЯК и БК встречаются значительно реже.
Еще одной эндоскопической характеристикой ЯК/ПСХ является отсутствие поражения прямой кишки, облигатного для изолированного ЯК. Эндоскопически интактная слизистая оболочка прямой кишки наблюдается у 5,6–66,4% пациентов с ЯК/ПСХ. Не исключено, что высокая частота этого признака объясняется ранее проводимой терапией [2].
Осложнения течения ВЗК, такие, как кишечные кровотечения при ЯК, стриктуры и пенетрации кишечника при БК, менее характерны для сочетанных с ПСХ форм заболеваний [2].
Наиболее частым и грозным осложнением ВЗК при ПСХ является колоректальный рак (КРР). 10-летний кумулятивный риск развития дисплазии толстой кишки и КРР у пациентов с ВЗК/ПСХ по некоторым данным достигает 11%, что выше, чем при изолированных типах ВЗК. Риск КРР остается высоким даже после перенесенной трансплантации печени. КРР регистрируется у 1,3–66,7% пациентов с ЯК/ПСХ [2]. При БК/ПСХ, в отличие от ЯК/ПСХ, не выявлено четкой ассоциации с повышенным риском развития КРР. Отличительной особенностью КРР при сочетанной патологии является его проксимальное расположение в толстой кишке, в отличие от более характерной для изолированного ЯК дистальной локализации.
Прогноз у пациентов с сочетанной патологией ВЗК/ПСХ хуже, чем при изолированном течении ЯК и БК, средняя продолжительность жизни составляет 10–12 лет. Это объясняется в большей степени частым развитием онкологических осложнений, а также постоянно прогрессирующим течением ПСХ [2].
1) Райхельсон К.Л., Пазенко Е.В., Марченко Н.В. Первичный склерозирующий холангит: обзор рекомендаций по диагностике и лечению заболевания. Consilium Medicum. 2017; 19 (8): 121–130.
2) Пазенко Е.В. Клинико-морфологические характеристики и особенности сочетанного течения первичного склерозирующего холангита и воспалительных заболеваний кишечника. Диссертация на соискание ученой степени к.м.н. Санкт-Петербург. 2022 г.
3) Винницкая, Е. В. и соавт. Актуальные вопросы диагностики и лечения первичного склерозирующего холангита (по материалам российского консенсуса по диагностике и лечению первичного склерозирующего холангита. Москва, 2018 г.). Терапевтический архив. – 2019. – Т. 91, № 2. – С. 9–15.
4) Harbord M, Annese V, Vavricka SR, et al. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis. 2016 Mar;10(3):239-54. doi: 10.1093/ecco-jcc/jjv213
5) Hirschfield GM, Karlsen TH, Lindor KD, Adams DH. Primary sclerosing cholangitis. Lancet. 2013 Nov 9;382(9904):1587-99. doi: 10.1016/S0140-6736(13)60096-3
6) Dyson JK, Beuers U, Jones DEJ, Lohse AW, Hudson M. Primary sclerosing cholangitis. Lancet. 2018 Jun 23;391(10139):2547-2559. doi: 10.1016/S0140-6736(18)30300-3
7) Karlsen TH, Folseraas T, Thorburn D, Vesterhus M. Primary sclerosing cholangitis - a comprehensive review. J Hepatol. 2017 Dec;67(6):1298-1323. doi: 10.1016/j.jhep.2017.07.022
8) Nakazawa T, Notohara K, Tazuma S, Tanaka A, Isayama H, Tsuyuguchi T, Mori T, Takikawa H. The 2016 diagnostic criteria for primary sclerosing cholangitis. J Gastroenterol. 2017 Jul;52(7):838-844. doi: 10.1007/s00535-016-1286-x
9) Tanaka A. IgG4-Related Sclerosing Cholangitis and Primary Sclerosing Cholangitis. Gut Liver. 2019 May 15;13(3):300-307. doi: 10.5009/gnl18085
10) Cazzagon N, Sarcognato S, Catanzaro E, Bonaiuto E, Peviani M, Pezzato F, Motta R. Primary Sclerosing Cholangitis: Diagnostic Criteria. Tomography. 2024 Jan 7;10(1):47-65. doi: 10.3390/tomography10010005
11) Chapman MH, Thorburn D, Hirschfield GM et al. British Society of Gastroenterology and UK-PSC guidelines for the diagnosis and management of primary sclerosing cholangitis. Gut. 2019 Aug;68(8):1356-1378. doi: 10.1136/gutjnl-2018-317993
12) Moiseev S, Cohen Tervaert JW, Arimura Y et al. 2020 international consensus on ANCA testing beyond systemic vasculitis. Autoimmun Rev. 2020 Sep;19(9):102618. doi: 10.1016/j.autrev.2020.102618