Наследственный ангиоотёк: клиническая картина и лабораторная диагностика
Определение
Наследственный ангиоотёк (НАО, устаревшее название – наследственный ангионевротический отёк) – редкое, потенциально жизнеугрожающее генетически детерминированное заболевание, проявляющееся в виде отёков кожи и слизистых/подслизистых оболочек, возникающих под воздействием брадикинина. Характерными особенностями отёков при НАО являются отсутствие зуда, гиперемии кожи, сопутствующей крапивницы, а также отсутствие эффекта от лечения системными глюкокортикостероидами и системными антигистаминными препаратами. Склонен к рецидивированию.
Этиология и патогенез
Наиболее частой причинной наследственного ангиоотёка является дефицит и/или снижение функциональной активности С1-ингибитора (С1-INH) вследствие аберраций в гене SERPING1. К настоящему времени известно более 450 патогенных вариантов в данном гене. Наследование НАО с дефицитом С1-ING в абсолютном большинстве случаев происходит по аутосомно-доминантному типу, однако имеются единичные данные об аутосомно-рецессивном типе наследования. Примерно у 20-25%пациентов заболевание обусловлено вновь возникшей аберрацией в гене SERPING1, то есть семейный анамнез отсутствует.
С1–ингибитор – сериновая протеаза, которая принимает участие в регуляции работы следующих систем: системы комплемента, калликреин-кининовой системы, системы свертывания крови по внутреннему пути и фибринолитической системы. Наибольшее значение имеет влияние фермента на калликреин-кининовую систему: в отсутствии С1-INH (и/или при снижении его функциональной активности) происходит неконтролируемое превращение прекалликреина в калликреин, под воздействием которого расщепляется высокомолекулярный кининоген с образованием брадикинина. Этот эффект усиливает активизация XII фактора свертывания крови (FXII) в результате запуска свертывания крови по внутреннему механизму (также обусловленному отсутствием и/или нарушением функциональной активности С1-INH).
Брадикинин – основной медиатор отёков при НАО. Вследствие взаимодействия брадикинина с брадикининовыми рецепторами 2 типа (B2) происходит вазодилятация, повышается проницаемость сосудистой стенки с экстравазацией жидкости, обуславливающей развитие ангиоотёка различной локализации. При выраженном ангиоотёке слизистой оболочки кишечника возникает клиника острой кишечной непроходимости. Брадикинин быстро расщепляется на пептиды эндогенными металлопротеиназами (включая АПФ).
Несмотря на активизацию процессов свертывания крови, у пациентов с НАО не отмечено повышенной склонности к тромбообразованию, благодаря тому, что в отсутствии С1-INH активизирована также и система фибринолиза, что приводит к повышенной трансформации плазминогена в плазмин.
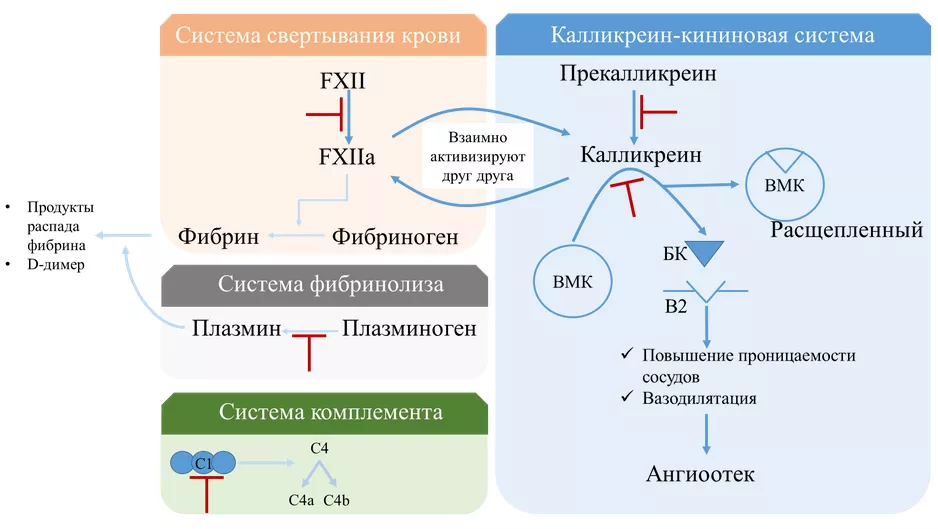
Рисунок 1. Патогенез НАО с дефицитом С1-ингибитора [1]. Красными стрелками обозначено ингибирующее действие C1-INH
В 1% случаев НАО не связан с аберрациями в гене SERPING1 и обусловлен патогенными вариантами в одном из генов: FXII, PLG, ANGPT1, KNG1, MYOF, HS3ST6. Данная патология является крайне редкой и получила название наследственный ангиоотёк с нормальным уровнем С1-INH. Далее данная форма заболевания подробно рассматриваться не будет.
Эпидемиология
Распространенность НАО с дефицитом С1-INH составляет 1:50 000. По состоянию на 2024 г. в Российском регистре пациентов с НАО было зарегистрировано 472 пациента [1]. Характерен ранний дебют заболевания в первой или второй декаде жизни, однако возможно более позднее появление первых симптомов вплоть до пожилого возраста. У большинства пациентов прослеживается семейный анамнез, однако у 25% пациентов он отсутствует
Классификация
НАО с дефицитом С1-INH:
-
НАО I типа обусловлен снижением количества и функциональной активности С1-INH в плазме, которые составляют менее 50% от нормы (85% всех случаев НАО).
-
НАО II типа обусловлен снижением функциональной активности С1-INH более чем на 50% от нормы, при этом уровень С1-INH сохраняется в пределах нормы или повышен (15% всех случаев НАО).
Клиническая картина
Клиническая картина заболевания проявляется ангиоотёком различной локализации, нечувствительным к терапии системными антигистаминными препаратами и системными глюкокортикоидами.
К наиболее частым клиническим проявлениям заболевания относятся:
1. Рецидивирующие периферические ангиоотёки – наиболее частое клиническое проявление заболевания, встречающееся практически у 100% пациентов с НАО. Характерными особенностями ангиоотёков (АО) являются отсутствие зуда, гиперемии кожи, сопутствующей крапивницы. АО медленно нарастают, их средняя продолжительность 2-4 суток. Возможно наличие покалывания, жжения, болезненности в месте АО. Верхние и нижние конечности – наиболее частая локализация. Часто могут возникать АО лица.
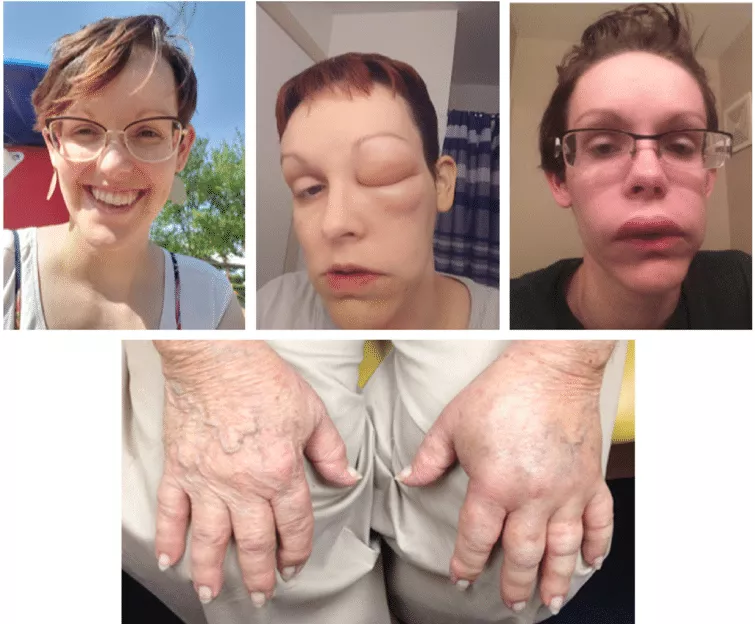
Рисунок 2. Наследственный ангиоотёк лица и рук у разных пациенток [5]
2. Абдоминальные атаки – второй по частоте симптом, встречающийся у пациентов с НАО (более 80%). Клинические проявления могут варьировать от дискомфорта до острой боли в области живота, сопровождающейся рвотой, диареей или запором, вздутием, резкой слабостью (при развитии асцита возникает гиповолемия). С помощью визуализирующих методов исследования (УЗИ или КТ органов брюшной полости) можно выявить отёк участка кишечника и свободную жидкость в брюшной полости или полости малого таза. Абдоминальные атаки часто являются причиной необоснованного хирургического вмешательства, так как симптомы имитируют клинику «острого живота». Нередко абдоминальные атаки являются первым клиническим проявлением заболевания, что затрудняет постановку диагноза.
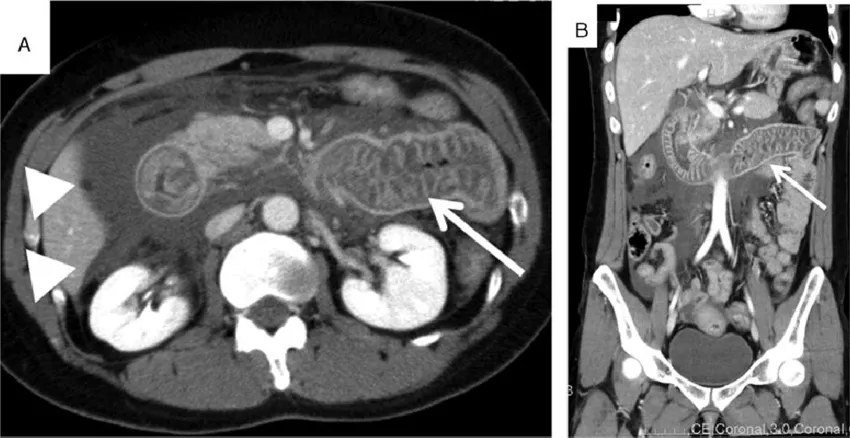
Рисунок 3. КТ органов брюшной полости у пациента с абдоминальной атакой, вызванной наследственным ангиоотёком [6]. Стрелкой показан отёк стенки кишки, треугольниками – асцит.
3. Ангиоотёки, способные привести к асфиксии (жизнеугрожающие АО): АО гортани, языка и небной занавески. При АО языка отмечается существенное увеличение его в объеме, часто язык не помещается в ротовой полости.
![Отёк лица и языка у пациентки с наследственным ангиоотёком [7] Отёк лица и языка у пациентки с наследственным ангиоотёком [7]](/upload/dev2fun.imagecompress/webp/medialibrary/bbc/4.webp)
Рисунок 4. Отёк лица и языка у пациентки с наследственным ангиоотёком [7]
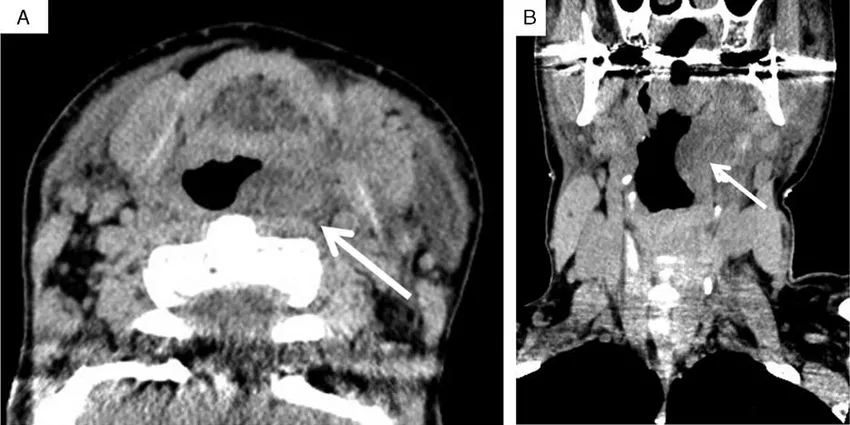
Рисунок 5. КТ шеи у пациента с наследственным ангиоотёком [6]. Стрелкой показано сдавление дыхательных путей (угроза асфиксии)
4. К более редким клиническим проявлениям заболевания относят:
Интенсивные головные боли, сопровождающиеся ощущением сдавления головы, ощущением давления в глазных яблоках, нечувствительных к действию анальгетиков (возникают при АО мозговых оболочек);
-
Сильные боли при мочеиспускании, прерывистое мочеиспускание, затруднение мочеиспускания вплоть до анурии (возникающие при АО мочевого пузыря и уретры);
-
Ангиоотёк мышц, характеризующиеся ограниченным уплотнением мышцы;
-
Ангиоотёк суставов;
-
Ангиоотёк пищевода (проявляется болью и/или ощущением сдавления в области грудной клетки, не сопровождающиеся изменениями на электрокардиограмме.
У пациентов могут быть «предвестники» АО: колебание настроения, депрессия, слабость, парестезии, ощущение утолщения кожи, маргинальная эритема.
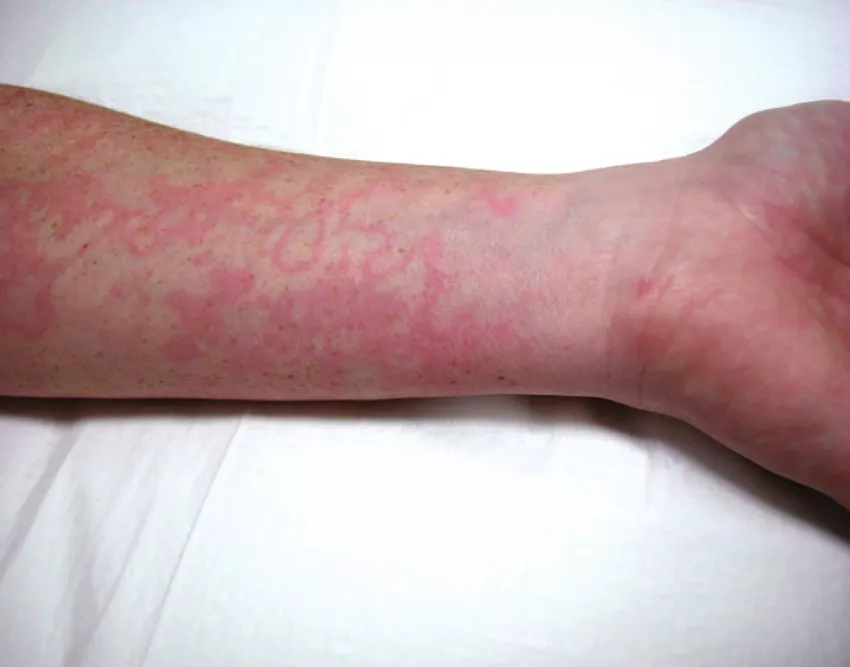
Рисунок 6. Маргинальная эритема у пациента с наследственным ангиоотёком
Маргинальная эритема – не возвышающиеся над поверхностью кожи высыпания розово-красного цвета, без зуда и шелушения, проходящие бесследно в течение нескольких часов – двух суток. Могут быть самостоятельным проявлением заболевания или являться «предвестниками» развития ангииотёка.
Триггеры развития ангиоотёка:
-
механическая травма (в том числе, длительное сдавление, укол, ушиб, оперативные вмешательства, стоматологические вмешательства, инвазивные методы обследования и др.);
-
острые инфекции;
-
декомпенсация любой сопутствующей патологии;
-
менструация, беременность, лактация;
-
прием препаратов, содержащих эстрогены;
-
прием ингибиторов АПФ, антагонистов рецепторов ангиотензина II;
-
стресс
Лабораторная диагностика наследственного ангиоотёка
Таблица 1. Объем обследования при наследственном ангиоотеке
|
Тест |
Показания |
Комментарий |
|---|---|---|
|
Исследование уровня ингибитора C1-эстеразы (С1-INH) и функциональной активности С1-INH
|
Диагностика НАО, дифференциальная диагностика НАО I/II. В настоящее время считается, что исследование уровня и функциональной активности C1-INH является наиболее чувствительным и специфичным методом исследования для постановки диагноза НАО I и II типов. Генетическая диагностика показано только в специальных случаях (см. ниже)
|
НАО I типа диагностируется в случае, когда уровень С1-INH и уровень его функциональной активности составляют менее 50% от нормы. НАО II типа диагностируется при выявлении снижения функциональной активности С1-INH более чем на 50% от нормы при отсутствии диагностически значимого снижения уровня С1-INH. Необходимо проведение подтверждающих исследований с интервалом не менее чем в 1 месяц. |
|
Скрининговый тест |
У пациентов с НАО I и II типов отмечается снижение С4 компонента комплемента, уровень С3 и С50 при НАО обычно нормальный. |
|
|
Молекулярно-генетическая диагностика врожденного ангионевротического отека (ген SERPING1) |
Исследование не является рутинным и показано для постановки диагноза НАО I или II только в следующих случаях: 1) при расхождении клинических и лабораторных данных; 2) детям до 1 года, у которых есть клинические признаки НАО и/или есть семейный анамнез НАО, для ранней постановки диагноза. |
В норме у детей до 1 года уровни С1-INH и его функциональной активности значительно ниже, чем у взрослых, поэтому использование этих показателей у детей до года с целью диагностики НАО неинформативно, показано генетическое тестирование. |
|
Исследование уровня С1q фракции компонента комплемента |
Всем взрослым пациентам с дефицитом С1-INH и рецидивирующими АО без крапивницы, но без семейного анамнеза или выявленной мутации в гене SERPING1 рекомендуется исследование уровней С1q фракции компонента комплемента и определение наличия антител к С1q в крови для исключения ПАО |
Уровень С1q снижен при ПАО и не изменяется при НАО |
|
Антитела к С1q выявляются при ПАО и не выявляются при НАО |
1) Исследование системы комплемента
В соответствии с рекомендациями WAO/EACCI 2017 г. [2] и рекомендациями МЗ РФ [1], всем пациентам с подозрением на наследственный ангионевротический отёк, необходимо проводит тестирование на C1-INH (количественное определение C1-INH + функциональная активность C1-INH) и скрининг системы комплемента (уровень С4 снижен при НАО I и II, уровень С3 и С50 обычно нормальный).
НАО I типа диагностируется в случае, когда уровень С1-INH и его функциональная активность составляют менее 50% от нормы. НАО II типа диагностируется при снижении функциональной активности С1-INH более чем на 50% от нормы при отсутствии диагностически значимого снижения уровня С1-INH.
Комментарии:
- Измененные показатели требуют подтверждения с интервалом не менее чем 1 месяц. Желательно проведение хотя бы одного из исследований во время развития ангиоотека, особенно в случае, если данные клинической картины не соответствуют результатам проведенных исследований.
- Принимая во внимание, что период полувыведения C1-INH составляет 62 часа, целесообразно проводить измерения не ранее, чем через 3 дня после отмены препарата ингибитора С1-эстеразы человека. Икатибант не влияет на сроки проведения анализов.
- У здоровых женщин уровень С1-INH и его функциональной активности в плазме крови снижаются во время беременности и возвращаются к норме после родоразрешения, поэтому результаты анализов должны интерпретироваться с осторожностью, исследование для подтверждения диагноза НАО следует повторить после родоразрешения.
- В случае если у пациента выявлен патогенный вариант в гене SERPING1, проведение повторного исследования уровня С1-INH в крови и функциональной активности С1-INH в крови не является обязательным.
- У пациентов с НАО I и II типов отмечается снижение С4 компонента комплемента, однако данный показатель не может быть использован для постановки диагноза, так как он может быть снижен при многих других заболеваниях (рекомендации МЗ РФ 2024 г) [1].
- По данным US HAEA Medical Advisory Board 2020 Guidelines [3], определение уровня С4 может использоваться для скрининга НАО I и II типов (чувствительность 81–96%). Нормальный уровень С4 исключает диагноз НАО I и II.
- Пациентам с подозрением на НАО не рекомендуется определение уровня С2 и С3 фракций комплемента ни с целью скрининга, ни с целью постановки диагноза (рекомендации МЗ РФ 2024 г) [1].
2) Молекулярно-генетическая диагностика наследственного ангиоотёка (ген SERPING1)
В настоящее время считается, что исследование уровня и функциональной активности C1-INH является наиболее чувствительным и специфичным методом исследования для постановки диагноза НАО I и II типов. Генетическая диагностика показано только в специальных случаях: 1) при расхождении клинических и лабораторных данных; 2) детям до 1 года, у которых есть клинические признаки НАО и/или есть семейный анамнез НАО, для ранней постановки диагноза.
В норме у детей до 1 года уровни С1-INH и его функциональной активности значительно ниже, чем у взрослых. Поэтому использование этих показателей у детей до года с целью диагностики НАО неинформативно. Также неинформативным считается исследование концентрации комплемента в пуповинной крови доношенных новорожденных, так как его уровень ниже, чем уровни у взрослых. Уровни антигена и функциональная активность С1-INH соответствуют 70% и 62% от показателей у взрослых, соответственно.
Дифференциальная диагностика наследственного ангиоотёка
Всем пациентам с подозрением на НАО рекомендуется проводить дифференциальную диагностику со следующими заболеваниями с целью уточнения диагноза:
-
Приобретенный ангиоотёк (ПАО) с дефицитом/нарушением функциональной активности С1-INH;
-
АО, вызванными приемом ингибиторов АПФ и антагонистов рецепторов ангиотензина II;
-
АО, вызванными медиаторами тучных клеток;
-
Идиопатическими АО;
-
Псевдоангиоотёками (гипопротеинемические отёки, синдром Мелькерссона-Розенталя, синдром верхней полой вены и др)
Тактика лечений данных состояний различна.
Приобретённый ангиоотёк
В 94% случаев заболевание дебютирует в возрасте после 40 лет. Преимущественно развиваются отеки лица, языка, гортанного язычка, верхних дыхательных путей. Желудочно-кишечные атаки менее распространены. У этих пациентов часто встречаются лимфопролиферативные заболевания (лимфома, моноклональная гаммапатия и т.д.).
ПАО имеют схожую клиническую картину и являются фенокопией НАО (не наследуется). Патология в системе комплемента обусловлена выработкой антител к С1-INH или повышенным его потреблением. При ПАО уровень С1-INH может быть в норме или снижен, функциональная активность С1-INH должна быть снижена на 50% от нижней границы нормы.
Всем взрослым пациентам с дефицитом С1-INH и рецидивирующими ангиоотеком без крапивницы, без семейного анамнеза или выявленного патогенного варианта в гене SERPING1 рекомендуется исследование уровня С1q в крови и определение наличия антител к С1q в крови для исключения ПАО. Большинство (70%-80%) пациентов с ПАО с дефицитом С1-INH имеют низкий уровень C1q и/или антитела к C1q. При НАО с дефицитом С1-INH уровень C1q как правило нормальный, антитела к C1q отсутствуют.
Ангиоотек, связанный с ингибиторами АПФ
Ингибирование ангиотензин-превращающего фермента (АПФ), который участвует в разрушении брадикинина до неактивных пептидов, приводит к повышению уровня плазменного брадикинина, что может вызывать развитие ангиоотека. Метаанализ клинических исследований, оценивающих ангионевротический отек в качестве побочного эффекта лекарственных препаратов, показывает, что частота АО на фоне ингибиторов АПФ составила 0,3%, блокаторов рецепторов ангиотензина II – 0,11%, прямых ингибиторов ренина – 0,13%, плацебо – 0,07%. Риск развития АО на фоне приема ингибиторов АПФ выше у курильщиков, лиц женского пола, лиц старше 65 лет, афроамериканцев (выше в 3–4,5 раза), пациентов, одновременно принимающих глиптины для лечения сахарного диабета или иммунодепрессанты.
Ангиоотеки, связанные с приемом ингибиторов АПФ, наиболее часто сопровождаются отеками лица, губ, век, языка, шеи, верхних дыхательных путей. Отеки кишечника встречается редко. Чаще всего отеки возникают в первый месяц приема препарата, однако у ряда пациентов (не менее 25%) первый эпизод развивается спустя 6 месяцев и более. Некоторые пациенты принимают ингибиторы АПФ в течение многих лет, прежде чем возникнет первый эпизод АО. Почти у 50% пациентов возникают рецидивы АО, продолжающиеся и после отмены ингибиторов АПФ. Причины этого явления изучены недостаточно хорошо.
Специфических лабораторных тестов для диагностики не существует. Диагноз устанавливается в случае исключения других возможных причин ангионевротического отека у пациентов, принимающих ингибиторы АПФ.
Ангиоотек, связанный с другими медиаторами тучных клеток
Данная разновидность ангиоотека встречается значительно чаще, чем НАО. В отличие от НАО, такой ангиоотек сопровождается крапивницей и зудом и купируется системными антигистаминными препаратами и системными глюкокортикоидами. В таблице 2 представлена классификация брадикинин-индуцированных ангиоотёков и ангиоотёков, индуцируемых другими медиаторами тучных клеток.
|
Брадикинин-индуцированный АО |
Индуцируемый другими медиаторами тучных клеток |
Неизвестные медиаторы
|
||||
|
дефицит С1-INH или его функциональной активности |
С1-INH в норме |
IgE-опосредованный |
не IgE-опосредованный |
|||
|
наследственный |
приобретенный |
наследственный |
приобретенный |
|||
|
НАО 1-го типа, НАО-2-го типа |
ПАО-C1-INH |
HAО nC1-INH, HAО-FXII, HAО-ANGPTI, HAО-PLG, HAО-UNK |
ИАПФ-AО |
Анафилактический АО с крапивницей |
Ангиоотекс крапивницей |
Идиопатический ангиоотек |
Критерии диагностики наследственного ангиоотёка (Российские рекомендации 2024 г.)
1. Диагностические критерии для первого обследуемого пациента в семье
1.1. НАО с дефицитом С1-ингибитора
≥1 критерия:
-
Рецидивирующие периферические АО
-
Рецидивирующие абдоминальные атаки
-
АО верхних дыхательных путей
Дополнительный критерий: семейный анамнез
И
≥1 критерия:
-
диагностически значимое снижение С1-INH и/или его функциональной активности в повторных исследованиях
-
выявление патогенных вариантов в гене SERPING1
1.2. НАО с нормальным уровнем С1-Ингибитора
≥1 критерия:
-
Рецидивирующие периферические АО
-
Рецидивирующие абдоминальные атаки
-
АО верхних дыхательных путей
Дополнительный критерий: семейный анамнез
И
Уровень С1-INH и его функциональной активности в двух исследованиях не снижены, или их снижение диагностически незначимо.
И ≥1 критерия:
-
наличие семейного анамнеза заболевания (симптомы более чем у 2-х членов семьи)
-
выявление патогенных вариантов в одном из генов: F12, PLG, ANGPT1, KNG1, MYOF, HS3ST6
2. Диагностические критерии для пациентов с клиническими проявлениями НАО, у которых есть член семьи с подтвержденным диагнозом НАО и установленным типом
2.1. НАО с дефицитом С1-ингибитора
У пациента есть родственник с подтвержденным диагнозом НАО и установленным типом, необходимо ≥1 критерия:
-
Рецидивирующие АО
-
Рецидивирующие абдоминальные атаки
-
АО верхних дыхательных путей
И/ИЛИ ≥1 критерия:
-
диагностически значимое снижение С1-INH и/или его функциональной активности
-
выявление патогенных вариантов в гене SERPING1 (как у родственника)
2.2. НАО с нормальным уровнем С1-Ингибитора
У пациента есть родственник с подтвержденным диагнозом НАО с нормальным уровнем С1-INH, необходимо ≥1 критерия:
-
Рецидивирующие АО
-
Рецидивирующие абдоминальные атаки
-
АО верхних дыхательных путей
И/ИЛИ (только для родственников пациентов, у которых выявлен патогенный вариант)
- выявление патогенного варианта в одном из генов (как у родственника): F12, PLG, ANGPT1, KNG1, MYOF, HS3ST6
При отсутствии у пациента симптомов устанавливается доклиническая стадия.
Таблица 2. Критерии диагностики наследственного ангиоотёка (US HAEA Medical Advisory Board 2020 Guidelines)
|
|
Весомость критерия |
Критерий |
|
НАО с дефицитом С1-INH |
Обязательный |
Рецидивирующий АО в анамнезе при отсутствии сопутствующей крапивницы и сопутствующего приема лекарств, вызывающих АО |
|
Обязательный |
Низкий (<50% от нормы) уровень антигена C1-INH или его функциональная активность |
|
|
Обязательный |
Низкий уровень С4 (исходно или во время приступа) |
|
|
Дополнительный |
Обнаружение патогенного варианта SERPING1 |
|
|
Дополнительный |
Семейный анамнез АО |
|
|
Дополнительный |
Возраст на момент дебюта заболевания <40 лет |
|
|
Весомость критерия |
Критерий |
|
НАО с нормальным уровнем С1-INH |
Обязательный |
Рецидивирующий АО в анамнезе при отсутствии сопутствующей крапивницы и сопутствующего приема лекарств, вызывающих АО |
|
Обязательный |
Нормальный или практически нормальный уровень антигена C1-INH, его функциональной активности, нормальный уровень С4 |
|
|
Как минимум один из признаков |
(1) Выявление аберрации в гене, ассоциированной с заболеванием |
|
|
(2) Семейный анамнез рецидивирующего АО и документированное отсутствие эффективности терапии высокими дозами антигистаминных препаратов (например, цетиризина в дозе 40 мг/день или эквивалента) в течение как минимум 1 месяца или интервала, за который произошло три приступа |
||
|
Дополнительный |
Позитивный ответ на антибрадикининовую терапию |
|
|
Дополнительный |
Преобладающий документированный видимый периферический АО; у пациентов с преобладающими абдоминальными симптомами – признаки отека стенки кишечника по КТ или МРТ |
Таблица 3. Клиническая и лабораторная диагностика брадикининовых ангиоотеков (сводная таблица) [1, 4].
|
Клинический или лабораторный маркер |
Наследственный ангиоотек |
Приобретенный ангиоотек |
|||
|
НАО I типа |
НАО II типа |
НАО с норм. уровнем С1-INH |
Приобретенный дефицит С1-INH |
АО, вызванные иАПФ |
|
|
Клиническая картина |
Повторные АО без крапивницы продолжительностью > 48 ч. Продрома в виде маргинальной эритемы у 1/3 пациентов. |
Та же, что и при НАО I типа |
Та же, что и при НАО I типа. Нет маргинальной эритемы. Могут быть дольше интервалы между приступами. |
Та же, что и при НАО I типа. Часто развивается на фоне онкопатологии. |
Чаще у афроамериканцев, у женщин и у курильщиков |
|
Локализация АО |
Конечности, абдоминальные атаки, реже – лицо |
Та же, что и при НАО I типа |
1 – лицо, 2 – конечности, 3 – абдоминальные атаки; для НАО-PLG характерен отек языка
|
Чаще на лице, реже – периферические, абдоминальные, ротовая полость |
Голова (язык), шея |
|
Возраст дебюта |
Детско-юношеский, ухудшение в пубертатном периоде |
Тот же, что и при НАО I типа |
Обычно в пубертатном периоде |
>40 лет |
>40 лет |
|
Триггеры |
Стресс, травма, инфекции, эстрогены, усталость |
Те же, что и при НАО I типа |
Те же, что и при НАО I типа |
Сопутствующее заболевание |
иАПФ; БРАII реже вызывают АО |
|
С1-INH количественно |
↓(>50% от N) |
N/↑ |
N |
↓/N |
N |
|
Функциональная активность С1-INH |
↓(>50% от N) |
↓(>50% от N) |
N |
↓(>50% от N) |
N |
|
С4 |
↓(>50% от N) |
↓(>50% от N) |
N |
↓ |
N |
|
С1q |
N |
N |
N |
↓ |
N |
|
АТ к С1-INH |
- |
- |
- |
+ |
- |
|
Патогенные варианты в гене |
SERPING1 |
SERPING1 |
FXII, PLG, ANGPT1, KNG1, MYOF, HS3ST6 |
- |
- |
Обследование пробандов
Всем родственникам (в особенности детям) пациента с НАО I и II типов (даже при отсутствии клинических проявлений заболевания) рекомендовано проведение скринингового обследования: исследование уровня С1-INH в крови и исследование функциональной активности С1-INH в крови и/или поиск у пробанда ранее выявленного у родственника патогенного варианта в гене SERPING1 молекулярно-генетическими методами (для НАО с дефицитом С1-ING).
Всем родственникам (в особенности детям) пациента с НАО с нормальным уровнем С1-ИНГ (даже при отсутствии клинических проявлений заболевания) с целью своевременной диагностики НАО рекомендуется поиск у пробанда молекулярно-генетическими методами патогенного варианта, ранее выявленного у родственника.
1) Наследственный ангиоотёк. Клинические рекомендации МЗ РФ. 2024 г.
2) Maurer M, Magerl M, Ansotegui I et al. The international WAO/EAACI guideline for the management of hereditary angioedema -The 2017 revision and update. Allergy. 2018 Aug;73(8):1575-1596. doi: 10.1111/all.13384
3) Busse PJ, Christiansen SC, Riedl MA et al. US HAEA Medical Advisory Board 2020 Guidelines for the Management of Hereditary Angioedema. J Allergy Clin Immunol Pract. 2021 Jan;9(1):132-150.e3. doi: 10.1016/j.jaip.2020.08.046
4) Busse PJ, Christiansen SC. Hereditary Angioedema. N Engl J Med. 2020 Mar 19;382(12):1136-1148. doi: 10.1056/NEJMra1808012
5) Manning ME. Recognition and Management of Hereditary Angioedema: Best Practices for Dermatologists. Dermatol Ther (Heidelb). 2021 Oct;11(5):1829-1838. doi: 10.1007/s13555-021-00593-x
6) Hirose T, Kimbara F, Shinozaki M et al. Screening for hereditary angioedema (HAE) at 13 emergency centers in Osaka, Japan: A prospective observational study. Medicine (Baltimore). 2017 Feb;96(6):e6109. doi: 10.1097/MD.0000000000006109
7) Muna ND, Ahmed TA, Madaka SK et al. Hereditary Angioedema With a Normal Complement Level. Cureus. 2024 Jan 15;16(1):e52291. doi: 10.7759/cureus.52291
8) Гурьянова И.Е. Врожденный ангионевротический отек: молекулярные основы формирования, механизмы развития, особенности клинических проявлений, патогенетическая терапия. «Лабораторная диагностика. Восточная Европа», 2021, том 10, № 4.
9) Грищенко Е.А. Сложности дифференциальной диагностики наследственного ангионевротического отека. Аллергология и иммунология в педиатрии. 2015. №1 (40).
10) Sinnathamby ES, Issa PP, Roberts L et al. Hereditary Angioedema: Diagnosis, Clinical Implications, and Pathophysiology. Adv Ther. 2023 Mar;40(3):814-827. doi: 10.1007/s12325-022-02401-0
11) Patel G, Pongracic JA. Hereditary and acquired angioedema. Allergy Asthma Proc. 2019 Nov 1;40(6):441-445. doi: 10.2500/aap.2019.40.4267