Аутоиммунный гепатит
Определение
Аутоиммунный гепатит (АИГ) представляет собой хроническое воспалительное заболевание печени, возникающее вследствие иммунного повреждения гепатоцитов и характеризующееся наличием перипортального гепатита по данным биопсии, гипергаммаглобулинемии, печеночно-ассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию. Точная причина заболевания не ясна, однако предполагается, что в основе патогенеза лежит взаимодействие генетической предрасположенности и факторов внешней среды.
Диагноз аутоиммунного гепатита является диагнозом исключения. Он может быть поставлен только после исключения вирусного гепатита, холестатических аутоиммунных заболеваний печени, токсических форм гепатита (алкогольного и лекарственного), болезни Вильсона, гемохроматоза, дефицита α1-антитрипсина.
Без лечения аутоиммунный гепатит приводит к фиброзированию печени (циррозу), что в конечном счете проявляется развитием печеночной недостаточности. Тем не менее, при ранней диагностике и своевременном лечении иммуносупрессивными препаратами, аутоиммунный гепатит как правило поддаётся лечению. При отсутствии эффекта от лекарственной терапии трансплантация печени может быть единственным методом лечения у пациентов с выраженным поражением печени.
Помимо аутоиммунного гепатита (АИГ), в группу аутоиммунных заболеваний печени также входят первичный билиарный холангит (ПБХ), который ранее назывался первичный билиарный цирроз (ПБЦ), а также первичный склерозирующий холангит (ПСХ) и перекрестные синдромы.
История изучения вопроса
В начале 1950-х годов шведский врач Ян Вальденстрем, а затем Kunkel и соавторы описали новый вид хронического гепатита с определенными особенностями, такими как предрасположенность к заболеванию у молодых женщин, прогрессирующий характер течения и высокая частота смертельных исходов, наличие артралгий, эндокринной дисфункции, кожных стрий и угревой сыпи, очень высокий уровень иммуноглобулинов в сыворотке, коррелирующий с повышением содержания плазматических клеток в печени. В 1955 г. у этих пациентов был установлен «феномен клеток красной волчанки», на основании чего группа Яна Маккея в 1956 г. предложила термин «волчаночный гепатит». Спустя десятилетие этот термин был заменен термином «аутоиммунный гепатит», который в 1990-е годы был принят Международной группой по изучению АИГ (IAIHG).
В настоящее время установлено, что АИГ представляет собой особый клинический синдром, характеризующийся значительной гетерогенностью клинических, лабораторных и гистологических проявлений. Об АИГ следует думать при обследовании любого пациента с острым или хроническим поражением печени, особенно при наличии гипергаммаглобулинемии, а также если у пациента имеются сопутствующие аутоиммунные заболевания (АИЗ).
Эпидемиология
Аутоиммунный гепатит является редким заболеванием. Его частота в европейских странах составляет 0,1–1,9 на 100000 населения в год, а распространенность – 15-25 случаев на 100000 населения.
Аутоиммунным гепатитом страдают преимущественно женщины (75% больных). Соотношение женщин и мужчин среди больных аутоиммунным гепатитом в Европе составляет 3,5–4:1, в странах Южной Америки – 4,7:1, в Японии – 10:1. Кроме того, у женщин с АИГ по сравнению с мужчинами, страдающими данным заболеванием, чаще встречаются сопутствующие АИЗ (34 против 17%).
Тем не менее, заболевание описано среди пациентов всех возрастов, обоих полов и различных этнических групп. Болеют как дети, так и взрослые, женщины и мужчины, в любом возрасте.
У детей чаще всего выделяется АИГ 2 типа, чаще в возрасте 6-10 лет. У детей это заболевание нередко манифестирует в острой форме и лишь позже переходит в хроническую форму. Примерно 1/3 детей с аутоиммунным гепатитом нуждается в трансплантации печени. В России в структуре хронических гепатитов у детей доля АИГ составляет 2,0%.
На долю 1-го типа, представляющего собой классический вариант заболевания, приходится более 90% всех случаев АИГ. Значительно чаще болеют женщины. Соотношение женщин и мужчин составляет 1:3-4. АИГ 1-го типа встречается в любом возрасте, но чаще от 10 до 20 лет или от 45 до 70 лет.
АИГ 2-го типа составляет до 10% всех случаев АИГ, большая часть заболевших – дети от 2 до 14 лет, хотя он может встречаться даже у пожилых людей. Соотношение женщин и мужчин – 6:4.
В целом, традиционные представления об АИГ как о редком заболевании молодых женщин с острым желтушным началом существенно пересмотрены.
Заболеваемость и распространенность АИГ по сравнению с показателями, зафиксированными до 2000 г. увеличились в 2,8–3,1 раза, особенно среди женщин и взрослых старше 65 лет. Увеличение заболеваемости и распространенности АИГ развивается параллельно росту заболеваемости другими АИЗ. Центральную роль здесь, по-видимому, играют факторы окружающей среды (воздействие ксенобиотиков, стресс, питание и прочее).
Этиология
Этиология АИГ неизвестна. Тем не менее, предполагается, что некоторые факторы (вирусная инфекция, лекарственные препараты, воздействие внешней среды) могут запускать аутоиммунный процесс. Так, отмечено, что у ряда пациентов с АИГ заболевание развивалось после инфицирования вирусным гепатитом А, B или вирусом Эпштейна-Барра. Также прием некоторых препаратов (метилдопа, нитрофурантоин, миноциклин, адалимумаб, инфликсимаб) может приводить к развитию клинической картины, схожей с проявлениями аутоиммунного гепатита. Несмотря на то, что большинство проявлений исчезают после отмены препарата, отмечаются случаи дальнейшего прогрессирования хронического заболевания.
Таблица 1. Возможные этиологические факторы аутоиммунного гепатита.
|
|
Лекарственные препараты:
|
Патогенез
Несмотря на то, что патофизиологические механизмы АИГ в настоящее время не до конца изучены, имеющиеся данные позволяют предположить, что ключевыми факторами в развитии заболевания являются:
1) генетическая предрасположенность
2) молекулярная мимикрия между эпитопами инфекционного агента и компонентами клетки
3) роль микробиоты и лекарств
4) нарушение баланса между эффекторными и регуляторными клетками иммунной системы.
Кроме того, известно, что у больных АИГ чаще обнаруживаются другие АИЗ, что доказывает важную роль генетической предрасположенности, обусловленную преимущественно генами системы HLA.
1) Генетическая предрасположенность
Восприимчивость и устойчивость к развитию аутоиммунного гепатита ассоциирована с аллельным вариантом DRB1 в составе комплекса HLA 6 хромосомы. Кроме того, европейские, американские и азиатские работы показывают, что существуют отдельные вариации данных аллелей, которые свойственны заболевшим в конкретном географическом регионе. Так, наличие аллелей DRB113 или DRB103 и DRB07 или DRB103 ассоциировано с предрасположенностью к аутоиммунному гепатиту в Южной Америке, азиатские исследования описывают повышенную восприимчивость у носителей DRB10405 и DRB10401. Особенно тяжелые варианты заболевания развиваются при наличии аллелей DRB10701 и DRB103-DRB1-04. По данным мета-анализа, проведенного в Латинской Америке, аллели DRB11302 и DQB10301увеличивают устойчивость к заболеванию.
По данным Американской ассоциации по изучению болезней печени (AASLD) с АИГ ассоциированы гаплотипы HLA-A1, Cw7, B8, TNFAB*a2b3, TNFN*S, C2*C, Bf *s, C4A*Q0, C4B*1, DRB1*03:01, DRB1*04:01, DRB1*13:01, DRB3*01:01, DQA1*05:01, DQB1*02:01, HLA-DRB1*03:01. За пределами комплекса HLA c АИГ ассоциированы полиморфизмы в генах CTLA4, TNFA, CD95, VDR, STAT4, TGFB1, MIF, SH2B3, IL23R (однако риск развития АИГ ниже, чем для вышеуказанных аллелей HLA) [5].
Пол является существенным фактором риска при многих АИЗ, и пациенты с АИГ не исключение: АИГ 1-го типа встречается у женщин в 3-4 раза чаще, чем у мужчин. Механизмы гендерной предрасположенности при АИЗ изучаются. С учетом того что многие гены, участвующие в иммунологической толерантности, расположены на Х-хромосоме, аномалии Х-хромосомы могут частично объяснить это преобладание. Также выявлено модулирующее влияние Х-хромосомы на врожденные и адаптивные иммунные механизмы.
2) Молекулярная мимикрия
Триггерная роль инфекционных агентов поддерживает гипотезу о молекулярной мимикрии и кросс-реактивности между чужими эпитопами и антигенами печени как важных звеньях патогенеза. Основными инфекционными агентами являются вирусы гепатита, Эпштейна-Барр, кори и простого герпеса.
Молекулярная мимикрия хорошо показана на примере АИГ-2, для которого типично наличие антител к LKM1. Мишенью для АТ к LKM1 является цитохром P450 2D6 (CYP2D6). Аминокислотная последовательность CYP2D6 демонстрирует высокий уровень гомологии с белками вируса гепатита С и герпес-вирусами (в частности, CMV и EBV).
3) Роль микробиоты и лекарств
Предполагается, что молекулярная мимикрия играет основную роль в развитии кишечных аутоиммунных реакций, ассоциированных с микрофлорой и различными лекарственными средствами. Изменения в составе микробиома могут приводить к повышению кишечной проницаемости, что в свою очередь облегчает проникновение бактерий в портальный кровоток. Нарушение кишечного барьера вследствие диеты или приема антибиотиков может запускать иммунное воспаление печени.
Кроме того, известна роль некоторых лекарств (таблица 1) в качестве пусковых факторов аутоиммунного гепатита. Важно уточнить, что лекарственно-индуцированный АИГ существенно отличается от лекарственно индуцированного повреждения печени. Тем не менее, в 9% случаев симптомы схожи, и клинически заболевания сложно различить. Известно, что метаболиты препаратов могут служить в качестве антигенов и приводить к продукции антител.
4) Нарушение баланса между эффекторными и регуляторными клетками иммунной системы.
Молекулы главного комплекса гистосовместимости и другие компоненты иммунной системы под воздействием вирусов, токсинов и микробиома стимулируют развитие T-клеточного иммунного ответа. Антиген-презентирующие клетки (АПК) представляют антиген наивным CD4+ T-хелперам, что приводит к секреции провоспалительных цитокинов (IL-12, IL-6 и TGFβ), которые запускают дифференцировку Th1, Th2, Th17 лимфоцитов. Th1 секретируют IL-2 и IFNγ, что приводит к усилению экспрессии комплексов HLA I и II класса на гепатоцитах. Treg и Th2 секретируют IL-4, IL-10 и IL-13, стимулируя созревание B-лимфоцитов и плазмоцитов, вырабатывающих антитела. Th17 лимфоциты, чей уровень коррелирует со степенью фиброза печени, секретирует провоспалительные цитокины и подавляет действие регуляторных клеток. Количественное снижение регуляторных клеток проявляется нарушением толерантности к аутоантигенам, что приводит к развитию аутоиммунного поражения печени. Гистологически это проявляется обильной инфильтрацией лимфоцитами и плазмоцитами ткани печени вокруг портальных трактов. 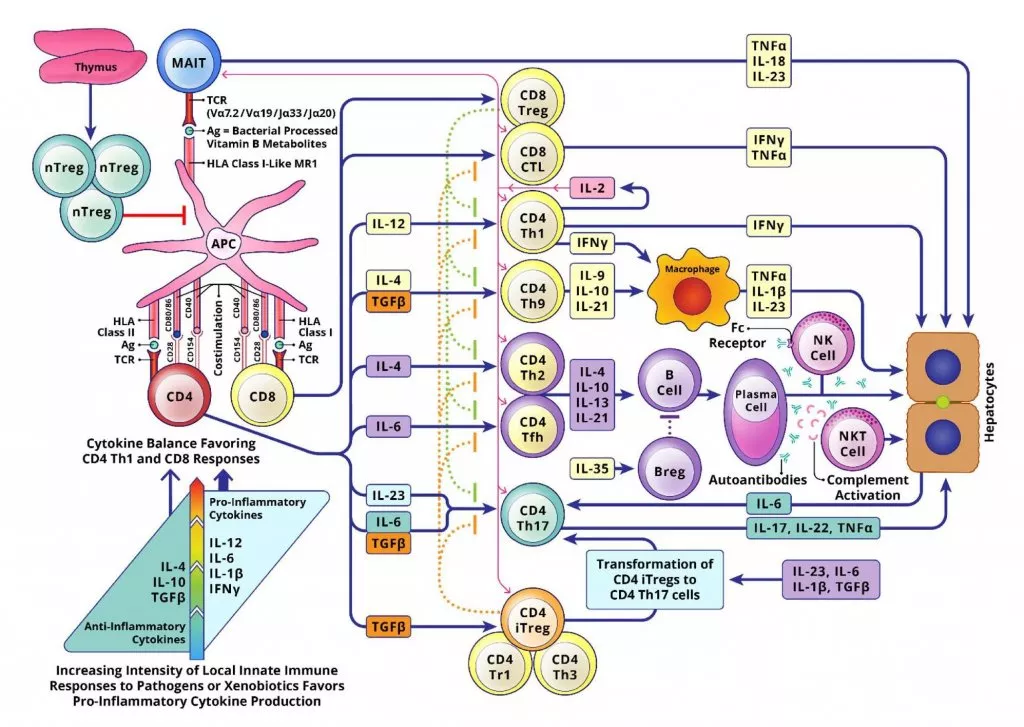
Рисунок 1. Молекулярный патогенез аутоиммунного гепатита [5]. Развернуть на весь экран.
На рисунке представлена многоэтапная рабочая модель иммунопатогенеза АИГ. Нарушение аутотолерантности к антигенам гепатоцитов инициирует иммунологический ответ, приводящий к прогрессирующему воспалению паренхимы печени с формированием очагов некроза и, в конечном счёте – к фиброзу. На первом этапе антиген-специфические Т-регуляторные клетки (nTregs) тимуса оказываются не способными предотвратить аутоиммунный ответ против антигенов печени, который запускается факторами внешней среды, такими как вирусная инфекция или ксенобиотики. На втором этапе АПК презентируют пептиды аутоантигенов аутореактивным α/β T-клеточным рецепторам (TCRs) на поверхности наивных CD4+ T-хелперов; CD8+ T-клетки и АПК активируют мукозо-ассоциированные инвариантные Т-клетки (MAIT), презентируя последним бактериально процессированные антигены витамина B. Костимуляция является критическим третьим этапом, она включает экспрессию Т-клетками генов, необходимых для пролиферации, дифференцировки и созревания аутоантиген-специфичных подтипов CD4+ T-хелперов (Th1, Th2, Th3, Th9, Th17, iTregs, Tr1, Tfh), а также CD8+ цитотоксических лимфоцитов (CTLs) и CD8+ Т-регуляторных клеток (Tregs). На четвертом этапе секреция цитокинов различными разновидностями Т-хелперов вызывает различные иммунологические реакции, включая CD4+ Th2-опосредованную стимуляцию продукции аутоантигенов B-клетками, CD4+ Th-опосредованную трансформацию В-клеток в секретирующие плазматические клетки, IL-35-зависимую стимуляцию Т-регуляторными клетками (Treg) В-регуляторных клеток (Breg) и CD4+ Th17-опосредованную цитотоксичность. Неспособность CD4+ и CD8+ Tregs и Bregs остановить аутоантиген-специфичные эффекторные механизмы приводит к повреждению печени. Кроме того, воздействие определенных цитокинов на CD4+ iTregs может привести к трансформции этих регуляторных клеток в цитотоксические CD4+ Th17 клетки. На шестом этапе происходит формирование портальных воспалительных инфильтратов из эффекторных клеток, вызывающих повреждение перипортальных и лобулярных гепатоцитов. Деструкция гепатоцитов приводит к активации перипортальных звездчатых клеток, которые усиливают локальный иммунный ответ, в результате чего развивается прогрессивный перипортальный фиброз, который без иммуносупрессивной терапии приводят к развитию цирроза печени.
Классификация АИГ
В настоящее время выделяют АИГ 1-го и 2-го типов.
АИГ 1-го типа характеризуется наличием в сыворотке антинуклеарных антител (antinuclear antibodies, ANA, АНА) и/или антигладкомышечных антител (smooth muscle antibody, SMA); могут выявляться АТ к SLA/LP. АИГ 1-от типа ссоциирован с HLA DR3, DR4 и DR13. На долю этого типа, представляющего собой классический вариант болезни, приходится более 90% всех случаев АИГ. АИГ 1-го типа встречается в любом возрасте, но чаще от 10 до 20 лет или от 45 до 70 лет. Значительно чаще болеют женщины: соотношение женщин и мужчин составляет 1:3-4. Редко отмечается неэффективность лечения, однако наблюдается вариабельная частота рецидивов после отмены препаратов и различная потребность в длительной поддерживающей терапии.
АИГ 2-го типа характеризуется наличием в сыворотке антител к микросомам клеток печени и почек типа 1 (anti-LKM 1). Могут выявляться анти-LC1, редко анти-LKM3 АТ. Ассоциирован с HLA DR3 и DR7. АИГ 2-го типа составляет до 10% всех случаев АИГ, большую часть больных составляют дети от 2 до 14 лет. Соотношение женщин и мужчин – 6:4. Заболевание может протекать тяжело, вплоть до развития фульминантного гепатита и быстрым прогрессированием до стадии цирроза. АИГ 2-го типа более резистентен к иммуносупрессивной терапии; отмена препаратов обычно ведет к рецидиву.
Выделение АИГ 3-го типа в настоящее время большинством специалистов не поддерживается, так как его серологический маркер, антитела к растворимому печеночному антигену (анти-SLA), встречается как при АИГ 1-го типа, так и при АИГ 2-го типа. Антитела к растворимому печеночному антигену (анти-SLA), как оказалось впоследствии, идентичны ранее описанным антителам к белкам печени/поджелудочной железы (анти-LP) и поэтому названы антителами анти-SLA/LP. Различия между АИГ-1 и АИГ-3 выражены меньше, чем между АИГ-1 и АИГ-2. Некоторые авторы отмечали более тяжелое течение заболевания и необходимость иммуносупрессивной терапии на протяжении всей жизни у большинства, если не у всех пациентов с АИГ-3. В настоящее время АИГ 3-го типа рассматривается как вариант АИГ 1-го типа.
Таблица 2. Сравнительная характеристика АИГ-1 и АИГ-2
|
|
АИГ-1 |
АИГ-2 |
|---|---|---|
|
Возраст дебюта |
Дети и взрослые. Характерно два пика заболеваемости: от 10 до 20 лет или от 45 до 70 лет |
Дети и подростки; характерный возраст – от 2 до 14 лет |
|
Антитела |
Анти-LKM1, анти–LC1, анти-LKM3 АТ |
|
|
Частота встречаемости |
1.5–3.0 на 100,000 в год |
<0.5 на 100,000 в год |
|
Генетическая предрасположенность |
HLADRB1*0301, HLADRB1*0401, HLADRB1*0405, HLADRB1*0404, HLADRB1*1301, HLADRB1*0301 |
HLADRB1*07, |
|
Ассоциированность с внепеченочными АИЗ |
Ассоциирован с внепеченочными АИЗ в 20% случаев (АИЗ щитовидной железы, артриты, ВЗК) |
Чаще всего ассоциирован с внепеченочными АИЗ (АИЗ щитовидной железы, СД-1, б. Аддисона, артриты) |
|
Степень тяжести |
Течение обычно нетяжёлое |
Средней степени тяжести или тяжёлое, в т.ч. острая печеночная недостаточность |
|
Ответ на терапию |
Обычно хорошо отвечает на терапию ГКС и азотиоприном |
Часто хорошо отвечает на терапию ГКС и азотиоприном, однако при АИГ 2-го типа чаще, чем при АИГ 1-го типа требуется трансплантация печени, особенно при острой печеночной недостаточности |
Клиническая картина
Аутоиммунный гепатит характеризуется широким спектром клинических проявлений: от бессимптомного до тяжелого, с наличием или без внепеченочных проявлений.
Наиболее часто (у 2/3 пациентов) клиническая картина заболевания характеризуется стертым началом без каких-либо симптомов или с наличием одного или нескольких из следующих неспецифических проявлений: утомляемость, общее недомогание, боль в правом подреберье, сонливость, отсутствие аппетита, снижение массы тела, тошнота, сыпь, периодически возникающая желтуха и полиартралгия мелких суставов без артрита. Иногда пациенты вспоминают, что подобные симптомы были уже несколько лет назад.
Возможно острое начало АИГ (около 25 % пациентов); наблюдаются две различные клинические формы (обострение хронического АИГ и истинный острый АИГ без гистологических проявлений хронического поражения печени); у пациентов с острым началом обычно определяется центрилобулярная зона некроза (центральный перивенулит), аутоантитела или другие классические проявления могут отсутствовать (появляются позже), не всегда отмечается эффект от приема кортикостероидов. Острое тяжелое начало встречается в 5% случаев с фульминантной печеночной недостаточностью.
Бессимптомный АИГ встречается в 25%-34% случаев. У данной категории нередко отмечается спонтанное лабораторное улучшение (12%), однако гистология печени существенно не отличается от гистологии пациентов с симптомами. Симптомы у пациентов данной группы появляются в течении 2-120 месяцев (в среднем, через 32 месяца). Показатели десятилетней выживаемости у этих пациентов значительно ниже, чем у пациентов с более тяжёлым течением заболевания, получавших терапию (67% против 98%).
Примерно у 1/3 взрослых и 1/2 детей с АИГ на момент обращения за медицинской помощью имеется цирроз печени, независимо от наличия симптомов. Это обусловлено скрытым течением заболевания и несвоевременной диагностикой.
Ещё один вариант начала АИГ – появление лихорадки с внепеченочными проявлениями (аутоиммунный тиреоидит, язвенный колит, гемолитическая анемия, идиопатическая тромбоцитопения, сахарный диабет, целиакия и др.). Желтуха при этом варианте течения появляется позже. Заболевание непрерывно прогрессирует и не имеет самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических показателей не происходит.
Лабораторная диагностика
АИГ характеризуется повышенным уровнем аминотрансфераз, органоспецифическими аутоантителами, гипергаммаглобулинемией.
Характерны изменения следующих лабораторных показателей:
-
повышение уровня АЛТ, ACT (начиная от З-х до бoлee чем 50-кратного превышения ВГН) — синдром цитолиза;
-
нормальная или умеренно повышенная активность ферментов, характерных для синдрома холестаза: ГГТП и ЩФ
-
общий билирубин повышается при остром или тяжелом течении АИГ;
-
MHO > 1,5 - при остром или тяжелом течении АИГ;
-
мезенхимально-воспалительный синдром: гипергаммаглобулинемия >1,1 ВГН; повышение уровня IgG > 1,1 ВГН, нарастание СОЭ, реже СРБ
-
в сыворотке нормальное содержание α1-антитрипсина, меди и церулоплазмина.
-
отрицательные тесты на вирусы гепатита А,В,С.
Определение уровня иммуноглобулинов.
Повышенный уровень IgG, особенно в отсутствие цирроза, служит отличительным признаком АИГ. Селективное повышение IgG при отсутствии повышения IgA и IgM особенно характерно для АИГ. При этом нормальный уровень IgG не исключает диагноз АИГ: у 15 % пациентов с АИГ-1 и у 25 % пациентов с АИГ-2 уровень IgG находится в пределах референсных значений, особенно при остром дебюте заболевания. Повышенный уровень IgA или IgM указывает на возможное наличие других заболеваний, алкогольный стеатогепатит и ПБЦ соответственно. У большинства пациентов после начала лечения наблюдается снижение уровня IgG. Нормализация активности аминотрансфераз и уровня IgG, таким образом, рассматривается как диагностический маркер полной биохимической ремиссии.
Выявление специфических антител
АИГ 1-го типа характеризуется наличием в сыворотке антинуклеарных антител (ANA, АНА) и/или антител к гладким мышцам (SMA, АГМА); могут выявляться АТ к SLA/LP. АНА и АГМА служат маркерами АИГ-1, но не являются специфическими и обладают широким диапазоном гетерогенности в плане антигенной специфичности, а также широкого спектра титров.
Антинуклеарные антитела. Таргетными антигенами являются различные молекулы, обнаруживаемые в клеточном ядре: хроматин, гистоны, двухцепочечная ДНК, рибонуклеопротеиды, центромеры, циклин А и другие компоненты ядра. Ядерных антигенов, специфичных для АИГ, не существует. Характер флюоресценции АНА в Hep2-клетках при АИГ обычно гомогенный, хотя нередко встречается и пятнистое окрашивание. Эти антитела обнаруживают у 75-95% (по другим данным, у 40–80%) пациентов с АИГ-1.
Антитела к гладким мышцам реагируют с миофиламентами в цитоплазме гладкомышечных клеток, основным из которых является фибрилларин (F-актин). Существует несколько видов антител к гладким мышцам, в том числе к фибриллярному (F-) актину, тубулину и десмину. Среди них только антитела к F-актину являются маркером аутоиммунного гепатита, в то время как антитела к тубулину, десмину и виментину встречаются при ревматических заболеваниях и вирусных инфекциях и самостоятельного клинического значения не имеют. Актин представляет собой глобулярный белок массой 46 кДа, который составляет основную массу микрофиламентов эукариотической клетки. Актин может существовать как в мономерной (М-), так и полимеризованной фибриллярной (F-) форме. Аутоантитела при аутоиммунном гепатите реагируют только с F-формой этого белка. Связывание аутоантител зависит от конформации эпитопов, поэтому выделение F-актина в нативном виде затруднено. В связи с этим основным методом выявления антител к F-актину является непрямая иммунофлюоресценция, которая позволяет максимально сохранить аутоантиген. АГМА, направленные против F-актина, рассматриваются в качестве наиболее чувствительного маркера аутоиммунного гепатита 1 типа, хотя их встречаемость при этом заболевании составляет только 50-70%. В большинстве случаев они выявляются совместно с антинуклеарным фактором на НЕр-2 клеточной линии. В 10% случаев АГМА могут отмечаться при первичном билиарном холангит (циррозе). АГМА класса IgA часто встречаются у больных с целиакией. АГМА практически не встречаются на фоне вирусных гепатитов.
АИГ 2-го типа характеризуется наличием в сыворотке антител к микросомам клеток печени и почек типа 1 (анти-LKM 1) в 70% случаев. Могут выявляться анти-LC1 АТ (30%), редко анти-LKM3 АТ. Также могу выявляться АТ к SLA/LP (20-30%).
Главная мишень-аутоантиген для анти-LKM1 – это цитохром P4502D6 (CYP2D6), для анти-LC1 — формиминотрансфераза циклодезаминаза (FTCD). Несмотря на то что целевой антиген четко установлен, ни анти-LKM1, ни анти-LC1 не специфичны для АИГ. Они описаны также у небольшой части (5–10 %) взрослых и детей с хроническим гепатитом C. Наличие гомологичных последовательностей у CYP2D6 и белков вируса гепатита С (HCV) служит основой для появления анти-LKM1-антител у пациентов с гепатитом C, которые генетически предрасположены к АИГ (главным образом, DRB1*07-позитивные), через механизм молекулярной мимикрии. Выработка анти-LKM1 антител может быть также индуцирована некоторыми лекарственными препаратами (тиенамом, дигидралазином, галотаном, фенитоином, фенобарбиталом, карбамазепином).
Анти-LKM1 АТ и анти-LC1 АТ входят в диагностическую панель Антитела к антигенам аутоиммунных заболеваний печени (иммуноблоттинг), позволяющую проводить диф. дифагноз между АИГ и ПБХ(Ц).
Антитела к асиалогликопротеиновому рецептору (анти ASGPR). Асиалогликопротеиновый рецептор экспрессируется клетками печени, основной его функцией является связывание гликопротеинов сыворотки крови с последующим эндоцитозом. Местом его преимущественной экспрессии являются перипортальные гепатоциты. Антитела к асиалогликопротеиновому рецептору отмечаются у 60-80% больных с АИГ 1 и 2 типов в дебюте и при обострении заболевания. Несколько чаще антитела отмечаются у детей с АИГ. Частота обнаружения аутоантител при ремиссии и эффективной терапии несколько ниже (10-30%). Антитела к асиалогликопротеиновому рецептору, выявляемые с помощью иммуноферментного теста второй генерации, редко выявляются при других аутоиммунных заболеваниях, поэтому их следует рассматривать в качестве специфического маркера аутоиммунного гепатита. Редко положительные результаты могут быть обнаружены при вирусном гепатите С. Антитела к асиалогликопротеиновому рецептору коррелируют с активность аутоиммунного гепатита, концентрацией трансаминаз и гистологией, их содержание может использоваться для мониторинга эффективности терапии и прогнозировании обострений заболевания.
Анти-SLA/LP АТ – единственное аутоантитело, специфичное для АИГ и поэтому обладающее высокой диагностической значимостью. Установлено, что антигеном-мишенью для этого антитела служит синтаза, конвертирующая О-фосфосерил-тРНК в селеноцистеинил-тРНК. Анти-SLA/LP определяются примерно у 20-30 % пациентов с АИГ. Анти-SLA/LP АТ входят в диагностическую панель Антитела к антигенам аутоиммунных заболеваний печени (иммуноблоттинг), позволяющую проводить диф. дифагноз между АИГ и ПБХ(Ц).
Антитела к цитоплазме нейтрофилов (ANCA, АНЦА). У пациентов с АИГ-1 также часто присутствуют атипичные АНЦА (20-96%, в среднем, в 50% случаев). Обычно выявляются атипичные АНЦА (xАНЦА), которые в отличие от МПО-АНЦА и ПР3-АНЦА направлены против антигенов, находящихся на периферии ядра. Последние данные свидетельствуют о том, что антиген-мишень локализован в ядерной мембране, в связи с чем некоторые авторы описывают эти антитела как перинуклеарные антинейтрофильные ядерные (пАНЦА). Положительное окрашивание может служить дополнительным показателем в пользу диагноза АИГ, особенно если анализ на другие аутоантитела дал отрицательный результат.
Антимитохондриальные АТ (АМА) – специфический серологический маркер ПБХ, иногда (8–12 %) обнаруживается у пациентов с классическим фенотипом АИГ без признаков ПБХ и может служить показателем наличия ПБХ(Ц) как сопутствующего или основного заболевания.
Наша лаборатория также предлагает следующие диагностические панели:
Скрининг аутоиммунного поражения печени, нРИФ (включает АГМА, АНА на клеточной линии Hep-2, анти-LKM1, АМА, антитела к париетальным клеткам желудка). Сочетание тестов направлено на первичное обследование для исключения основных аутоиммунных заболеваний печени.
Антитела к антигенам аутоиммунных заболеваний печени, иммуноблотинг (включает АТ к антигенам АМА-М2, М2-3Е, Sp100, PML, gp210, LKM-1, LC-1, SLA/LP, SSA/Ro-52). Этот тест является подтверждающим при обнаружении АМА М2 и LKM1 антител, а также он позволяет выявить антитела к растворимому печеночному антигену SLA/LP и антитела к цитозольному антигену печени LC-1, которые встречаются при АИГ2 совместно с LKM антителами. Остальные антигены (SP-100, PML, gp210) выявляются при ПБХ и относятся к антинуклеарным антителам, часто сочетаясь с типом свечения «точки в ядре».
Развернутая серология аутоиммунных заболеваний печени, нРИФ и иммуноблотинг (объединяет две вышеописанные панели). Представляет собой наиболее полное и подробное обследование при подозрении на аутоиммунные заболевания печени.
Согласно рекомендациям EASL и комитета по аутоиммунной серологии IAIHG, алгоритм исследования аутоантител в сыворотках крови больных АИГ включает два этапа:
На первом этапе выполняются скрининговые иммунодиагностические тесты первой линии:
-
Определение anti-SMA, антител к LKM-1, LC-1 в сыворотке крови методом нРИФ с использованием «тройного субстрата» - тканевого комплекса криосрезов печени-почки-желудка крысы/мыши (диагностические титры >1:40 у взрослых, >1:20 у детей). Данным методом также могут вы являться AMA-M2 (при сочетании АИГ-ПБХ).
-
Определение ANA в с сыворотке крови методом нРИФ с использованием в качестве субстрата HEp-2 клеток (диагностические титры > 1:160). нРИФ на HEp-2 клетках считается эталонным скрининговым методом исследования ANA, который по сравнению с нРИФ на тканевых срезах, позволяет не только существенно повысить чувствительность метода, но и дифференцировать различные типы ядерного и цитоплазматического свечения (включая паттерны, характерные для антител к sp100, gp210, центромерами AMA-M2 при сочетании АИГ-ПБХ).
-
Определение антител к SLA/LP в сыворотке крови методами ИФА или иммуноблоттинга.
На втором этапе выполняются подтверждающие и дополнительные иммунодиагностические тесты второй линии для выявления специфических печеночных аутоантител:
-
Определение антител к F-актину, LKM-1, LKM-3, LC-1, sp100, gp2l0 подтверждающими методами ИФА и ИБ в сыворотках крови пациентов с положительными результатами скринингового исследования ANA, anti-SMA, антител к LKM-1 и LC-1.
-
Определение атипичных pANCA в сыворотке крови методом нРИФ на нейтрофилах человека, фиксированных этанолом и формальдегидом (дополнительные тест).
-
Определение anti-ASGPR в сыворотке крови методом ИФА (дополнительный тест).
Таблица 3. Аутоантитела при аутоиммунном гепатите
|
Аутоантитела |
Таргетные антигены |
Методы определения |
Заболевания |
|
|
Скрининговые |
Подтверждающие |
|||
|
Различные молекулы, обнаруженные в клеточном ядре: хроматин, гистоны, двухцепочечная ДНК, рибонуклеопротеиды, центромеры, циклин А и другие компоненты ядра. Однако ядерных антигенов, специфичных для АИГ, не существует |
нРИФ на НЕр-2-клетках |
ИФА, иммуноблот для определения антител к sp100, gp210, центромерам |
В 75–95% при АИГ-1.
Также: ПБХ, ПСХ, перекрестные синдромы, лекарственное поражение печени, вирусные гепатиты В и С, болезнь Вильсона, НАЖБП |
|
|
Антитела к гладкой мускулатуре (ASMA), антитела к F-актину, альфа-актинину, тропонину, тропомиозину |
Микрофиламенты (F-актин), средние филаменты (виментин, десмин) |
нРИФ на криостатных срезах печени/почек/ желудка крыс (мышей) |
ИФА, иммуноблот |
В 75% при АИГ-1. Также: ПБХ, ПСХ, перекрестные синдромы, лекарственное поражение печени, вирусные гепатиты В и С, болезнь Вильсона, НАЖБП |
|
CYP2D6 |
нРИФ на криостатных срезах печени/почек/желудка крыс (мышей) |
ИФА, иммуноблот |
В 70% при АИГ-2. Также при вирусном гепатите С |
|
|
Формимино-трансфераза-циклодезаминаза |
НРИФ на криостатных срезах печени/почек/желудка крыс (мышей) |
Иммуноблот |
В 30% при АИГ-2. Также при вирусном гепатите С |
|
|
Антитела к растворимому антигену печени/ поджелудочной железы (SLA/LP) |
Синтаза (S), конвертирующая О-фосфосерил-тРНК (Sep) в селеноцистеин-тРНК (Sec) (SepSecS) |
ИФА, иммуноблот |
- |
В 20-30% при АИГ-1 и АИГ-2 |
|
Тубулин-бета, локализованный в ядерной мембране нейтрофилов; белки с локализацией в ядре (гистоновый белок Н1, негистоновые белки хроматина HMG-1 и HMG-2), гранулах (катепсин G, эластаза, лизоцим, β-глюкуронидаза, лактоферрин, BPI) и цитоплазме (α-энолаза, каталаза) нейтрофилов |
нРИФ на нейтрофилах с фиксацией формалином |
ИФА, иммуноблот |
В 20-96% при АИГ-1.
Также при ПСХ, ВЗК |
|
|
Антитела к LKM3 |
УДФ-глюкуронозилтрансфераза 1-1 (UGT-1A) |
|
|
АИГ-2, гепатит D |
|
Асиалогликопротеиновые рецепторы (ASGPR) |
ИФА |
- |
АИГ-1,АИГ-2 ПБХ, вирусный гепатит В, С, D; лекарственный гепатит |
|
|
Антитела к LM |
CYP2A6 |
|
|
APECED, гепатит С, дигидралазин-индуцированный гепатит |
|
E2-субъединица пируват-дегидрогеназного комплекса |
|
|
ПБХ(Ц), перекрестный синдром ПБЦ-АИГ, АИГ-1 (редко) |
|
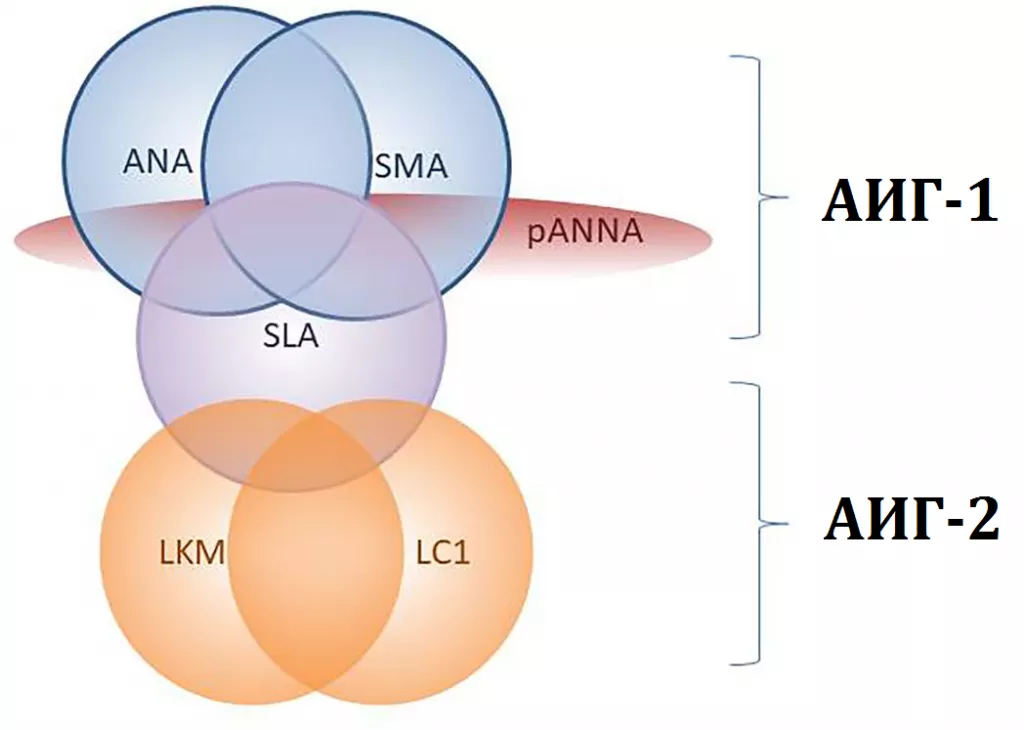
Рисунок 2. Спектр антител при аутоиммунном гепатите 1-го и 2-го типов
Биопсия печени.
Всем пациентам с АИГ рекомендуется проведение биопсии печени, дающей возможность определения степени активности воспалительного процесса и стадии заболевания, а также исключения других нозологических форм. Гистологическая картина при АИГ характеризуется наличием перипортального или перисептального гепатита: лимфоплазмоцитарная инфильтрация в сочетании или без лобулярного компонента и порто-портальных или порто-центральных ступенчатых некрозов, часто с образованием розеток печеночных клеток и узловой регенерации. Необходимо отметить, что специфических гистологических признаков АИГ не существует, и отсутствие плазмоцитарной инфильтрации не исключает диагноз.
Портальные повреждения обычно не затрагивают желчные протоки, гранулемы встречаются редко. Иногда встречаются центролобулярные (в 3-й зоне ацинуса) повреждения. При всех формах заболевания присутствует выраженный в той или иной степени фиброз.
Критерии диагностики
Экспертами Международной группы по изучению гепатита (IAIHG) в 1993 г. были предложены диагностические критерии. В 2008 г. они были пересмотрены и предложены в упрощенном виде для рутинного применения в клинической практике (см. ниже).
Таблица 4. Полные диагностические критерии IAIHG 1999 г. [4]
|
Признак/показатель |
Значение |
Баллы |
|
Пол |
женский |
+2 |
|
мужской |
+0 |
|
|
Отношение ЩФ/АЛТ (ЩФ/АСТ) |
<1.5 |
+2 |
|
1.5–3.0 |
+0 |
|
|
>3.0 |
–2 |
|
|
γ‑глобулин или IgG х ВНГ |
>2.0 |
+3 |
|
1.5–2.0 |
+2 |
|
|
1.0–1.5 |
+1 |
|
|
<1.0 |
+0 |
|
|
АТ: ANA, SMA или LKM-1 (титр) |
>1:80 |
+3 |
|
1:80 |
+2 |
|
|
1:40 |
+1 |
|
|
<1:40 |
+0 |
|
|
AMA |
Положительные |
–4 |
|
Маркеры вирусного гепатита |
Положительные |
–3 |
|
Отрицательные |
+3 |
|
|
Прием лекарств |
Да |
–4 |
|
Нет |
+1 |
|
|
Среднее количество алкоголя, употребляемое в день |
<25 г/день |
+2 |
|
>60 г/день |
–2 |
|
|
Биопсия печени (гистология) |
Гепатит с мультилобулярными некрозами гепатоцитов |
+3 |
|
Лифоплазмоцитарная инфильтрация |
+1 |
|
|
Розеткообразование гепатоцитов |
+1 |
|
|
Ничего из вышеперечисленного |
–5 |
|
|
Патология билиарного тракта |
–3 |
|
|
Другие изменения |
–3 |
|
|
Другие АТ |
|
+2 |
|
HLA DRB1*03 или DRB1*04 |
|
+1 |
|
Ответ на терапию |
Полный |
+2 |
|
Рецидив |
+3 |
|
|
Оценка до лечения: подтвержденный диагноз АИГ>15 баллов; вероятный диагноз АИГ: 10-15 баллов |
||
|
Оценка после лечения: подтвержденный диагноз АИГ>17 баллов; вероятный диагноз АИГ: 12-17 баллов |
||
Таблица 5. Упрощенные диагностические критерии IAIHG 2008 г. [2,4]
|
Признак/показатель |
Значение |
Баллы |
|
ANA или SMA+ |
≥ 1:40 |
+1а |
|
≥ 1:80 |
+2а |
|
|
или LKM+ |
≥ 1:40 |
+2а |
|
или SLA/LP+ |
любой титр |
+2а |
|
Уровень IgG или γ-глобулинов |
> ВГН |
+1 |
|
> 1,1 × ВГН |
+2 |
|
|
Гистология печени (наличие гепатита – необходимый признак) |
соответствует АИГ |
+1 |
|
типична для АИГ |
+2 |
|
|
нетипична для АИГ |
+0 |
|
|
Вирусный гепатит |
нет |
+0 |
|
|
да |
+2 |
|
Подтвержденный аутоиммунный гепатит: ≥ 7. Вероятный аутоиммунный гепатит: ≥ 6. а Добавление баллов для каждого из определяемых антител (максимум 2 балла).
|
||
Комментарий. Типичная гистология АИГ предполагает наличие всех признаков: перипортальный гепатит, лимфоцитарные или лимфоплазмоцитарные инфильтраты в портальных трактах и распространяющийся на дольки, эмпериполез (активное проникновение одной клетки в более крупную клетку без повреждения последней) и формирование гепатоцитарных розеток. Гистологическая картина, соответствующая АИГ: хронический гепатит с лимфоцитарной инфильтрацией без всего комплекса проявлений, считающихся типичными. Нетипичная картина — наличие признаков другого заболевания, например стеатогепатита.
Следует отметить, что диагностически значимые титры аутоантител у детей часто имеют более низкие значения, чем у взрослых. Кроме того, балльная диагностическая система IAIHG не позволяет дифференцировать АИГ и аутоиммунный склерозирующий холангит (АСХ), который возможно диагностировать только после проведения холангиографии. В связи с этим Европейское общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) в 2018 г. предложило усовершенствованную балльную систему для диагностики АИГ и АСХ у детей [12].
Таблица 6. Предлагаемые критерии диагностики аутоиммунных заболеваний печени у детей и подростков (ESPGHAN 2018 г.) [12].
|
Критерии |
Показатели |
Баллы |
|
|
АИГ |
АСХ |
||
|
ANA и/или ASMA* |
≥ 1:20# |
1 |
1 |
|
≥ 1:80 |
2 |
2 |
|
|
Anti-LKM-1* или |
≥ 1:10# |
1 |
1 |
|
≥ 1:80 |
2 |
1 |
|
|
Anti-LC-1 |
Положительно# |
2 |
1 |
|
Anti-SLA |
Положительно# |
2 |
2 |
|
pANCA |
Положительно |
1 |
2 |
|
IgG |
> ВГН |
1 |
1 |
|
> 1.20 х ВГН |
2 |
2 |
|
|
Данные гистологического исследования биоптата печени |
Не исключающие АИГ |
1 |
1 |
|
Типичные для АИГ |
2 |
2 |
|
|
Вирусные гепатиты (A, B, E, EBV), НАЖБП, болезнь Вильсона, ЛИПП |
Отсутствуют |
2 |
2 |
|
Внепеченочные аутоиммунные заболевания |
Есть |
1 |
1 |
|
Случаи аутоиммунных заболеваний в семье |
Есть |
1 |
1 |
|
Холангиография |
Изменения билиарных протоков отсутствуют |
2 |
–2 |
|
Обнаруживаются патологические изменения билиарных протоков |
–2 |
2 |
|
|
ИНТЕРПРЕТАЦИЯ. Количество баллов: ≥7 – вероятный диагноз АИГ; ≥8 – доказанный диагноз АИГ ≥7 – вероятный диагноз АСХ; ≥8 – доказанный диагноз АСХ |
|||
|
Примечание: АИГ (AIH) – аутоиммунный гепатит, ACХ (ASC) – аутоиммунный склерозирующий холангит; * — аутоантитела, определяемые с помощью непрямой иммунофлюоресценции на субстрате грызунов; # – сумма баллов, полученных за аутоантитела ANA, SMA, anti-LKM-1, anti-LC-1 и anti-SLA, не может превышать 2 баллов. |
|||
Около 10-15% пациентов не имеют известных аутоантител – это так называемый «серонегативный» вариант АИГ (СН АИГ). Частота предполагаемого серонегативного АИГ у больных с острыми тяжелым течением составляет около 7%, а у больных с хроническими проявлениями АИГ - 1-34%. Причины невыявления AT могут быть различны: AT вырабатываются в ходе болезни и после острого тяжелого дебюта АИГ и в дальнейшем будут определяться, или AT могут уже отсутствовать на стадии цирроза печени (т.н. «выгоревший» цирроз печени). Не до конца ясно, вносят ли существенный вклад AT в патогенез АИГ. Серонегативность при одном тестировании не может исключать АИГ. Повторные тесты могут быть необходимы для обнаружения AT. Пациенты с СН АИГ должны получать терапию и наблюдаться так же, как и пациенты с наличием AT. Отсутствие АТ не исключает диагноз АИГ, и при подозрении на заболевание рекомендуется обязательное проведение биопсии печени (при отсутствии абсолютных противопоказаний) для своевременной диагностики и проведения соответствующей иммуносупрессивной терапии.
Дифференциальная диагностика
- Другие аутоиммунные заболевания печени:первичный склерозирующий холангит (ПСХ), включая первичный склерозирующий холангит мелких протоков
хронический гепатит В с или без гепатита D
хронический гепатит С
- Холангиопатия вследствие ВИЧ-инфекции
- Алкогольная болезнь печени
- Лекарственное поражение печени
- Гранулематозный гепатит
- Целиакия
Вариантные формы АИГ
У некоторых пациентов развиваются «перекрестные синдромы» – сочетание АИГ с ПБХ, или ПСХ. В таких случаях диагноз установить довольно трудно в связи с отсутствием общепризнанных критериев. Сопутствующие холестатические проявления обусловливают необходимость исследования на антимитохондриальные АТ (АМА) и проведения холангиографии (особенно у детей с учетом риска развития аутоиммунного склерозирующего холангита)
Проявление АИГ возможно у беременных или (чаще) после родов. Обычно во время беременности активность заболевания угасает, но после родов часто возникают обострения; осложнения у матери и плода такие же, как в общей популяции
АИГ-подобное заболевание может развиться после трансплантации печени по поводу других заболеваний (АИГ de novo)
Описано развитие заболевания после вирусных инфекций (например, гепатит А, вирус Эпштейна-Барр, вирус герпеса 6-го типа, корь). АИГ следует рассматривать в качестве диагноза в случаях, когда необъяснимый и длительный гепатит наблюдается после вирусной инфекции
Описано развитие заболевания после приема препаратов, пищевых добавок или растительных препаратов (лекарственно-индуцированный АИГ — трудно дифференцировать с ЛПП). В большинстве случаев заболевание связано с применением нитрофурантоина и миноциклина. Также это может происходить после лечения биологическими препаратами (блокаторы ФНО-α, применение интерферона-α при лечении гепатита C).
Часто встречаются сопутствующие аутоиммунные или иммуноопосредованные заболевания у пациентов или родственников первой степени (тиреоидит Хашимото; тиреотоксикоз, витилиго, алопеция, ревматоидный артрит, сахарный диабет 1-го типа, ВЗК, псориаз, системная красная волчанка, синдром Шегрена, целиакия, панникулит, мононеврит, пигментная крапивница, идиопатическая тромбоцитопеническая пурпура, полимиозит, гемолитическая анемия, увеит)
Необычная форма АИГ встречается у 10–18 % пациентов с синдромом аутоиммунная полиэндокринопатия-кандидоз-эктодермальная дистрофия (APECED), известным как АПС-1
Перекрестные синдромы
АИГ может сочетаться с рядом других заболеваний печени, в частности с холестатическими заболеваниями — первичным билиарным холангитом (ПБХ) или первичным склерозирующим холангитом (ПСХ), а также с лекарственным повреждением печени (ЛПП), алкогольным и неалкогольным стеатогепатитом (НАСГ) или вирусным гепатитом. Перекрестный синдром характеризуется одновременным наличием признаков двух различных заболеваний печени, например, АИГ и ПБХ или АИГ и ПСХ. В настоящее время нет единого определения этого синдрома. Однако в любом случае о перекрестном синдроме можно говорить в тех случаях, когда при тщательной оценке всех биохимических, серологических, иммунологических и гистологических данных обнаруживаются признаки аутоиммунного гепатита и одного из двух упомянутых выше заболеваний.
Сочетание АИГ и холестатического поражения печени
Перекрестный-синдром АИГ/ПБХ наблюдается примерно в 8-10% (по другим данным, в 7–13%) всех случаев хронических заболеваний печени, преимущественно у женщин в периоде перименопаузы или старше 60 лет, АИГ/ПСХ – в 7-14% (по другим данным – в 6–11% случаев), чаще у подростков и молодых людей. Так называемый АМА-негативный ПБХ (около 10% всех случаев ПБХ), для обозначения которого используется еще в качестве синонима термин «аутоиммунный холангит», также может рассматриваться как проявление перекрестного синдрома.
Перипортальный (пограничный) гепатит — основополагающий компонент заболевания, поэтому при обследовании пациента с перекрестными проявлениями обязательно следует проводить биопсию печени. Степень перипортального гепатита может считаться мерой активности АИГ-подобного заболевания независимо от наличия сопутствующего холестатического поражения печени.
Единого мнения о патогенезе этих вариантных форм пока не сложилось. Есть мнение, что признаки АИГ развиваются у пациентов с иммуноопосредованным холестатическим поражением печени и генетической предрасположенностью к АИГ, о чем свидетельствует высокая распространенность HLA-генов DR3 или DR4 у больных ПБХ с признаками АИГ, что привело к появлению термина «вторичный АИГ» у пациентов с ПБХ и перекрестными признаками АИГ.
Сочетание аутоиммунного гепатита и первичного билиарного холангита (АИГ/ПБХ)
В настоящее время для диагностики варианта АИГ/ПБХ чаще всего применяют Парижские критерии, согласно которым необходимо наличие не менее двух из трех критериев каждого заболевания.
Таблица 7. Парижские критерии диагностики перекрестного синдрома АИГ/ПБХ [9;13]
|
Заболевание |
Критерии |
|---|---|
|
Первичный билиарный холангит (ПБХ) |
· ЩФ ≥ 2 ВГН или ГГТП ≥ 5 ВГН · Обнаружение AMA (титр ≥ 1 : 40) · Данные биопсии печени: негнойный деструктивный холангит |
|
Аутоиммунный гепатит (АИГ) |
· АЛТ ≥ 5 ВГН · IgG ≥ 2 ВГН или обнаружение anti-SMA · Данные биопсии печени: умеренное или тяжелое перипортальное/перисептальное воспаление; ступенчатые некрозы; лимфоцитарные розетки |
|
Необходимо наличие как минимум 2-х из 3-х критериев для каждого заболевания для постановки диагноза перекрестного синдрома АИГ/ПБХ |
|
Было показано, что данные критерии с высокой чувствительностью (92 %) и специфичностью (97 %) позволяют выявить пациентов с клиническим диагнозом варианта АИГ/ПБХ.
Следует отметить, что в отдельных случаях начало АИГ по времени не соответствует развитию ПБХ – обычно ПБХ развивается раньше. Тем не менее, в большинстве случаев можно установить одно первичное расстройство (доминирующее заболевание). Обычно это ПБХ.
Важно отметить, что Парижские критерии могут не выявлять пациентов с АИГ/ПБХ, у которых имеются менее выраженные лабораторные признаки холестаза. Группа IAIHG подчеркивает, что Парижские критерии не получили независимого подтверждения.
Антителак пируват-дегидрогеназе Е2 (антимитохондриальные АТ, АМА) присутствуют у 8%-12% пациентов с АИГ при отсутствии признаков поражения билиарного тракта. Эти пациенты обычно хорошо отвечают на терапию глюкокортикоидами, и у них не происходит развития ПБХ. Для окончательного дифференциального диагноза АИГ и ПБХ необходимо проведение биопсии печени.
Сочетание аутоиммунного гепатита и первичного склерозирующего холангита (АИГ/ПСХ)
Перекрестный синдром АИГ/ПСХ выявляется у 1,4–17% пациентов с АИГ. Сочетание АИГ и ПСХ описано и у детей, и у взрослых. Предполагается, что такая комбинация наблюдается у значительной части пациентов молодого возраста с аутоиммунным поражением печени. Под термином «перекрестный синдром АИГ/ПСХ», согласно рекомендациям EASL (2009 г.), понимают нечетко определенные иммунные расстройства с характерными гистологическими особенностями АИГ и типичными холангиографическими признаками ПСХ (признаки ПСХ крупного билиарного протока), отсутствием антимитохондриальных антител АМА. Это определение не учитывает возможность сочетания АИГ с ПСХ мелких протоков.
В 2011 г. Международной рабочей группой по аутоиммунному гепатиту (IAIHG) предложено классифицировать АИЗП только по основным диагнозам – АИГ, ПБХ и ПСХ или ПСХ мелких протоков, при этом последние могут протекать с признаками АИГ. То есть, согласно рекомендациям IAIHG, в случае перекрестного синдрома диагноз формулируется как ПСХ с признаками АИГ. Такая номенклатура призвана упростить для клиницистов процесс постановки и формулировки диагноза.
Следует отметить, что почти у половины детей с АИГ описана особая нозологическая форма, характеризующаяся как наличием проявлений АИГ, так и склерозирующего холангита. На этом основании Mieli-Vergani и соавторы ввели термин «аутоиммунный склерозирующий холангит» (АСХ), указывающий на необходимость исследования состояния билиарного дерева, по крайней мере с помощью МРХПГ, у всех детей с диагнозом АИГ. В настоящее время считается, что этот вариант наблюдается только у детей, поскольку результаты проспективного исследования у взрослых с АИГ дали отрицательный результат. Поэтому если АИГ развился в зрелом возрасте, то в отсутствие признаков холестаза проводить МРХПГ нецелесообразно. Однако МРХПГ рекомендуется выполнять практически всем молодым взрослым с АИГ и проявлениями холестаза, а также пациентам с АИГ с продолжающимся холестазом (даже при условии адекватной иммуносупрессии) с целью выявить ПСХ как основное или сопутствующее заболевание.
У пациентов с лабораторными признаками холестаза, отсутствием АМА, гистологическими данными, свидетельствующими в пользу ПСХ или ПБХ и нормальными данными холангиографии, может быть ПСХ малых протоков или АМА-негативный ПБХ.
Согласно статистическим данным, у 42% пациентов с АИГ и сопутствующим язвенным колитом имеют холангиографические изменения, типичные для ПСХ. ЯК присутствует у 45% детей с перекрестным синдромом ПСХ-АИГ. Т.о., диагноз перекрестного синдрома ПСХ-АИГ следует подозревать у всех пациентов с АИГ и сопутствующим хроническим ЯК, необъяснимыми признаками холестаза или отсутствием ответа на стандартную терапию глюкокортикоидами.
Таблица 8. Сравнительная характеристика АИГ-1, АИГ-2 и АСХ у детей [12].
|
Параметр |
Значения |
АИГ-1 |
АИГ-2 |
АСХ |
|---|---|---|---|---|
|
Женский пол |
|
80% |
80% |
50% |
|
Мужской пол |
|
20% |
20% |
50% |
|
ANA или SMA* |
≥ 1:20 |
++ |
+/- |
++ |
|
Anti-LKM-1* |
≥ 1:10 |
– |
++ |
+/- |
|
Anti-LC-1 |
положительные |
– |
++ |
– |
|
Anti-SLA |
положительные |
+ |
+ |
+ |
|
pANCA |
положительные |
+ |
– |
++ |
|
IgG |
>ВГН |
++ |
+ |
++ |
|
> 1.20 х ВГН |
++ |
+ |
++ |
|
|
Гистология печени (биопсия) |
не противоречит АИГ |
+ |
+ |
+ |
|
типична для АИГ |
+ |
+ |
+ |
|
|
Вирусные гепатиты (A, B, E, EBV), НАЖБП, болезнь Вильсона, ЛИПП |
|
– |
– |
– |
|
Внепеченочные аутоиммунные заболевания |
|
+ |
+ |
+ |
|
Случаи аутоиммунных заболеваний в семье |
|
+ |
+ |
+ |
|
Холангиография |
норма |
+ |
+ |
– |
|
патология |
– |
– |
+ |
|
|
Биохимический и иммунологический ответ на лечение стероидами |
да |
+ |
+ |
+ |
|
нет |
– |
– |
– |
|
|
Примечание: * — аутоантитела, определяемые с помощью непрямой иммунофлюоресценции на субстрате грызунов; |
||||
Таблица 9. Сравнительная характеристика АИГ, ПБХ и ПСХ
|
Параметры |
АИГ |
ПБХ |
ПСХ |
|
Пол |
Женщины: 60-75% |
Женщины >90% |
Женщины: 30-35% |
|
Возраст |
АИГ 1 - средний – 45 лет. АИГ 2 – 2-14 лет |
30-65 лет; не встречается у детей |
Типичный возраст 30-50 лет, но м.б. любой |
|
АЛТ и АСТ |
Обычно повышены в 3-10 раз, но м.б. нормальными |
Нормальные или незначительно повышены |
Нормальные или незначительно повышены |
|
ЩФ |
М.б. повышена |
Умеренно или значительно повышена |
Умеренно или значительно повышена (обычно 3 х ВГН) |
|
Билирубин |
Вариабельно повышен |
Вариабельно повышен, но нормальный при постановке диагноза |
Вариабельно повышен, но нормальный при постановке диагноза |
|
Иммуноглобулины |
Гипергаммаглобулинемия, повышение IgG, обычно 1.2-3.0 x ВГН |
Повышен IgM |
IgG повышен у 61%; IgM повышен у 45% |
|
Антинуклеарные АТ (АНА) |
Значительные титры (≥1:40) АНА и/или SMA у 70-80% при АИГ-1 |
АНА у >30% (анти-gp210 и анти-Sp100 высокоспецифичны) |
АНА у 8-77% |
|
АТ к гладким мышцам (SMA) |
SMA могут быть |
SMA могу быть у 0-83% |
|
|
анти-LKM1 АТ |
Высокоспецифичны для АИГ-2 |
|
|
|
анти-SLA/LP АТ |
10-30% |
Могут выявляться |
Могут выявляться |
|
pANCA |
pANCA у 50-96% (АИГ-1) |
|
pANCA у 26-94% |
|
AТ к митохондриям (АМА) |
Могут выявляться в низких титрах |
AMA у 90-95% (AMA anti-PDC-E2 высоко специфичны) |
Могут выявляться |
|
Биопсия печени |
|
||
|
Гепатит с мультилобулярными некрозами гепатоцитов |
Типичен |
Редко |
Редко |
|
Портальное воспаление |
Плазмоклеточная инфильтрация |
Лимфоцитарная инфильтрация |
Лимфоцитарная инфильтрация |
|
Патология билиарного тракта |
Редко |
Типична |
Типична |
|
Гранулематоз |
Нетипичен |
Неизменно присутствует |
Нетипичен, но может встречаться |
|
Холангиография |
Норма или признаки цирроза печени |
Норма или признаки цирроза печени |
Типичная картина ПСХ |
|
Воспалительные заболевания кишечника |
Редко ассоциированы с АИГ |
Редко ассоциированы с ПБХ |
Присутствуют в 70-80% случаев |
Лекарственно-индуцированный аутоиммунный гепатит
Наиболее сложный фенотип в дифференциальной диагностике АИГ – лекарственно-индуцированный аутоиммунный гепатит (ЛИ-АИГ).
АИГ – иммуноопосредованное заболевание, этиология которого неясна, развивается у лиц с генетической предрасположенностью и может быть спровоцировано факторами внешней среды, в том числе и ЛП. В таком случае отличить лекарственное поражение печени (ЛПП), которое может иметь клинико-лабораторную картину, аналогичную АИГ, и АИГ, триггером для которого послужил прием ЛП, крайне затруднительно. ЛИ-АИГ – это, по сути, форма идиосинкразической гепатотоксичности. Идиосинкразический тип ЛПП по всем своим признакам может имитировать АИГ, который, как известно, может быть непредсказуемым, не зависит от дозы ЛП, может также развиваться у лиц с генетической предрасположенностью с различным латентным периодом.
Метаболизм ЛП в печени может приводить к образованию реактивных метаболитов, которые связываются с белками и в дальнейшем распознаются иммунной системой как неоантигены, что у лиц с генетической предрасположенностью может привести к хроническому иммуновоспалительному процессу и постоянной необходимости в проведении ИСТ.
Не ясно, как рассматривать фенотип ЛИ-АИГ: как фенотип АИГ или фенотип ЛПП. В когортных исследованиях 2–9% случаев с диагнозом АИГ считались вызванными ЛП, и наоборот, АИГ, вызванный ЛП, составлял около 9% случаев всех ЛПП. По другим данным, частота от 2% до 17%.
Можно выделить несколько сценариев ЛИ-АИГ:
ЛПП с выраженной реакцией гиперчувствительности с иммуноаллергическим компонентом, которое будет имитировать АИГ;
АИГ, который будет имитировать ЛПП, если пациент в течение последнего времени принимал какие-либо ЛП и спонтанная ремиссия совпала с улучшением после отмены ЛП;
АИГ, спровоцированный приемом ЛП, между которыми крайне сложно бывает провести дифференциальные различия и определить причинно-следственную связь у таких пациентов.
Имеющиеся отличия ЛИ-АИГ от АИГ не являются абсолютными и патогномоничными для ЛИ-АИГ:
1) пол – не является строго отличительной особенностью ЛИ-АИГ в сравнении с АИГ;
2) ассоциация с HLA DRB1 реже наблюдается при ЛИ-АИГ;
3) реакция гиперчувствительности в клинической картине (лихорадка, кожная сыпь и гиперэозинофилия в общем анализе крови) несколько чаще наблюдается при ЛИ-АИГ;
4) при ЛИ-АИГ гораздо реже выявляются стандартные АТ (преимущественно в низких титрах) и редко – повышенный уровень IgG;
5) иммуноассоциированные заболевания при ЛИ-АИГ встречаются реже, чем АИГ;
6) цирроз печени на момент постановки диагноза при ЛИ-АИГ определяется реже;
7) особенности морфологической картины: крайне редко выявляются значимые гистологические различия между ЛИ-АИГ и АИГ.
Единственный достаточно специфичный критерий ЛИ-АИГ – это полный ответ на терапию, который наблюдается у пациентов с ЛИ-АИГ при отмене этиологического ЛП и короткого курса терапии ГКС, тогда как пациентам с АИГ требуется длительная ИСТ, и отсутствие рецидивов у пациентов с ЛИ-АИГ после прекращения короткого курса ИСТ.
Однако данные критерии можно оценить позже, поэтому все пациенты с ЛИ-АИГ после отмены ИСТ нуждаются в длительном наблюдении (каждые 6 месяцев в течение как минимум трех лет), чтобы не пропустить рецидив АИГ.
В эру активного применения ингибиторов иммунных контрольных точек (ИКТ) в терапии онкологических больных стали выделять определенный фенотип ЛПП – иммуноопосредованное поражение печени (ИОПП), ассоциированное с применением ИКТ, которое отличается от идиосинкразической и прямой гепатотоксичности. ИОПП развивается в результате иммуноопосредованного механизма действия ИКТ на определенные звенья ИС организма и косвенного действия на печень. Данный фенотип ЛПП не следует соотносить с ЛИ-АИГ. ИОПП, связанные с применением ИКТ, обычно улучшаются при терапии ГКС, но у таких пациентов отсутствуют лабораторные (АТ не выявляются, нормальный уровень IgG) и гистологические признаки, характерные для АИГ. Таким образом, в клинической практике дифференциальный диагноз ЛИ-АИГ и АИГ является непростой задачей: у пациентов с ЛИ-АИГ нет специфичных маркеров, так же как отсутствуют строго специфичные патогномоничные критерии идиопатического АИГ, и диагноз обычно устанавливается в соответствии с клинической ситуацией на основе эмпирического опыта гепатолога.
Таблица 10. Сравнительный анализ лекарственно-индуцированного АИГ-подобного поражения печени и истинного АИГ [5].
|
Признаки |
Лекарственно-индуцированное АИГ-подобное поражение печени |
АИГ |
|---|---|---|
|
Пол |
Преимущественно женщины |
Преимущественно женщины, но могут болеть и мужчины |
|
Острое начало |
Чаще всего (>60%) |
<20% |
|
Гиперчувствительность (лихорадка, сыпь, эозинофилия) |
До 30% |
Несвойственно |
|
Связь во времени с приемом препарата |
Есть |
Нет |
|
Ассоциация HLA DRB1*03:01 или DRB1*04:01 |
Нет |
Часто |
|
Конкурирующее АИЗ |
Редко |
В 14%-44% случаев |
|
Цирроз печени в дебюте |
Редко |
В 28%-33% случаев |
|
Терапия |
Отмена препарата, вызвавшего реакцию ± ГКС |
ГКС и азатиоприн |
|
Рецидив после отмены препарата |
Редко |
В 60%-87% случаев |
|
Прогрессия до цирроза печени |
Редко |
В 7%-40% случаев |
|
Выживаемость без трансплантации печени |
90%-100% |
10-летняя выживаемость 89%-91% |
Вирусный гепатит и АИГ
Отсутствие вирусных маркеров — один из пунктов диагностических критериев АИГ, но в странах с высокой распространенностью вирусного гепатита возможно одновременное сочетание АИГ и вирусного гепатита. В этих случаях, если в качестве одного из критериев АИГ считать отсутствие вирусного гепатита, то АИГ может остаться недиагностированным и, соответственно, оставаться без лечения.
Существует мнение, что у восприимчивых лиц АИГ может быть индуцирован вирусными инфекциями. Молекулярная мимикрия между вирусными эпитопами и эпитопами аутоантигенов подтверждает концепцию вирус-индуцированного АИГ. С другой стороны, имеющиеся немногочисленные публикации не лишены систематической ошибки двух видов. Во-первых, у пациентов с субклиническим ранее не распознанным АИГ диагноз может быть установлен при случайном развитии вирусного гепатита. Во-вторых, у пациентов с острым АИГ и выраженной гипергаммаглобулинемией могут наблюдаться ложноположительные результаты серодиагностики вирусных маркеров.
Обычно АИГ характеризуется более агрессивным течением и худшим прогнозом, чем вирусный гепатит (В или С). Тщательная оценка биопсии печени и определение аутоиммунных маркеров позволяют установить присутствие двойного механизма поражения печени. Гепатит C следует лечить в первую очередь. Если воспалительное поражение печени сохраняется, следует подумать о диагнозе АИГ.
Развитие АИГ или признаков АИГ также отмечено у некоторых пациентов с гепатитом С после лечения интерфероном-α и редко во время острого гепатита C даже после элиминации вируса. Дифференциальная диагностика между АИГ и хроническим гепатитом С в прошлом была сложна, в частности, из-за иммуностимулирующих побочных эффектов интерферона-α, однако вследствие внедрения безынтерфероновых схем лечения это больше не является клинической проблемой.
Аутоиммунный гепатит в сочетании с неалкогольной жировой болезнью печени
На основании многочисленных исследований в настоящее время гистологические признаки НАЖБП присутствуют у 17–30% взрослых пациентов с АИГ. Пациенты с АИГ/НАЖБП/метаболическим синдромом (МС) в сравнении с пациентами только с АИГ не отличаются по полу, достоверно чаще имеют пожилой возраст и признаки МС – артериальную гипертензию, сахарный диабет второго типа (СД 2) и ожирение; более низкие значения трансаминаз, но более высокий уровень IgG и повышенный уровень ферритина.
Окончательный диагноз АИГ у пациентов с НАЖБП и МС нередко имеет запоздалый характер, чаще устанавливается уже на стадии тяжелого фиброза или ЦП. Детальная оценка профиля АТ и гистологическое исследование печени являются обязательными у пациентов с НАЖБП при подозрении на АИГ. Многофакторный анализ выявил, что наличие стеатоза и/или СД 2 может быть предиктором неполного биохимического ответа и неудовлетворительных исходов и влиять на прогноз у пациентов с фенотипом АИГ и НАЖБП.
С целью дифференциальной диагностики рекомендуется выполнение теста Молекулярно-генетическое исследование при неалкогольной жировой болезни печени (вариант I148M гена PNPLA3).
АИГ и сопутствующие аутоиммунные заболевания
АИГ ассоциирован с наличием широкого спектра других аутоиммунных или иммуноопосредованных заболеваний. Частота встречаемости сопутствующих аутоиммунных заболеваний при АИГ составляет 14%-44%. При АИГ 1-го типа наиболее часто встречаются аутоиммунные заболевания щитовидной железы (10%-18%), при АИГ 2-го типа – сахарный диабет 1-го типа, аутоиммунные заболевания щитовидной железы и аутоиммунные поражения кожи (витилиго, лейкокластический васкулит, крапивница, алопеция).
Аутоиммунные заболевания щитовидной железы являются наиболее часто встречающимися сопутствующими АИЗ при АИГ (10–23%). Тиреоидит Хашимото встречается в 10.2–14.1% случаев, болезнь Грейвса – в 3–6%. Системная красная волчанка встречается у 2.8-3% пациентов с АИГ. Синдром Шегрена встречается у 2.8–7%, ревматоидный артрит – у 2–4% пациентов с АИГ. Воспалительные заболевания кишечника встречаются у 2–11.4% пациентов с АИГ; АИГ встречается у 3.7–11.4% пациентов с ВЗК. Язвенный колит ассоциирован с ПБХ, но и АИГ может наблюдаться у 2–8% этих пациентов. У пациентов с АИГ частота развития болезни Крона составляет 1–6%.
Внепеченочные аутоиммунные проявления чаще встречаются у женщин и зависят от возраста. У пациенток старше 60 лет аутоиммунное поражение щитовидной железы и ревматические болезни встречаются чаще, чем в возрасте моложе 30 лет (42% против 13%), в то время как к молодых пациенток чаще встречаются ВЗК и аутоиммунная гемолитическая анемия (13% против 0%). Сопутствующие АИЗ чаще встречаются у пациентов с фенотипом HLA DRB1*04:01 или с семейным анамнезом АИЗ. Частота встречаемости целиакии выше у пациентов с АИГ, чем в общей популяции (2.8%-3.5%), самая высокая частота целиакии была показана в итальянской группе детей с АИГ (16%).
Отдельного внимания заслуживает аутоиммунный гепатит при аутоиммунном полиэндокринном синдроме (АПС-1-АИГ). Аутоиммунный полиэндокринный синдром (АПС), называемый также аутоиммунным полигландулярным синдромом, включает в себя АИГ примерно в 15% случаев. АИГ при данном синдроме имеет черты 2-го типа. Часто он имеет острое, фульминантное течение и не так хорошо поддается иммуносупрессивной терапии, как АИГ без АПС. Данный синдром также носит название APECED (синдром аутоиммунной полиэндокринопатии, кандидоза, эктодермальной дистрофии) и вызван мутациями гена аутоиммунной регуляции (AIRE). Для аутоиммунного полиэндокринного синдрома 1 типа характерны: гиперпаратиреоз (89%), кандидоз кожи и слизистых (75%), недостаточность надпочечников (60%), первичный гипогонадизм (45%), гипотиреоз (12%), сахарный диабет 1 типа (1%), синдром малабсорбции (25%), хронический активный гепатит (9–20%)
1) Аутоиммунный гепатит у детей. Клинические рекомендации. 2016 г.
2) Рекомендации EASL по лечению аутоиммунного гепатита. 2015 г. (в переводе на русский язык)
3) Сандлер Ю.Г., Винницкая Е.В., Александрова Е.Н. Клинические фенотипы аутоиммунного гепатита. Эффективная фармакотерапия. 2024; 20 (2): 86–97.
4) Mieli-Vergani G, Vergani D, Czaja AJ et al. Autoimmune hepatitis. Nat Rev Dis Primers. 2018 Apr 12;4:18017. doi: 10.1038/nrdp.2018.17
5) Mack CL, Adams D, Assis DN et al. Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatology. 2020 Aug;72(2):671-722. doi: 10.1002/hep.31065
6) Korean Association for the Study of the Liver (KASL). KASL clinical practice guidelines for management of autoimmune hepatitis 2022. Clin Mol Hepatol. 2023 Jul;29(3):542-592. doi: 10.3350/cmh.2023.0087
7) Terziroli Beretta-Piccoli B, Mieli-Vergani G, Vergani D. Autoimmune Hepatitis: Serum Autoantibodies in Clinical Practice. Clin Rev Allergy Immunol. 2022 Oct;63(2):124-137. doi: 10.1007/s12016-021-08888-9
8) Boberg KM, Chapman RW, Hirschfield GM, Lohse AW, Manns MP, Schrumpf E; International Autoimmune Hepatitis Group. Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. J Hepatol. 2011 Feb;54(2):374-85. doi: 10.1016/j.jhep.2010.09.002
9) Gonzalez RS, Washington K. Primary Biliary Cholangitis and Autoimmune Hepatitis. Surg Pathol Clin. 2018 Jun;11(2):329-349. doi: 10.1016/j.path.2018.02.010
10) To U, Silveira M. Overlap Syndrome of Autoimmune Hepatitis and Primary Biliary Cholangitis. Clin Liver Dis. 2018 Aug;22(3):603-611. doi: 10.1016/j.cld.2018.03.010
11) Волынец Г.В., Хавкин А.И., Скворцова Т.А., Маткаш В.В. Аутоиммунный гепатит у детей: современное состояние проблемы. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018;28(5):18–34. https://doi.org/10.22416/1382-4376-2018-28-5-18-34
12) Mieli-Vergani G, Vergani D, Baumann U et al. Diagnosis and Management of Pediatric Autoimmune Liver Disease: ESPGHAN Hepatology Committee Position Statement. J Pediatr Gastroenterol Nutr. 2018 Feb;66(2):345-360. doi: 10.1097/MPG.0000000000001801
13) Chazouillères O, Wendum D, Serfaty L, Montembault S, Rosmorduc O, Poupon R. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy. Hepatology. 1998 Aug;28(2):296-301. doi: 10.1002/hep.510280203
14) Kuiper EM, Zondervan PE, van Buuren HR. Paris criteria are effective in diagnosis of primary biliary cirrhosis and autoimmune hepatitis overlap syndrome. Clin Gastroenterol Hepatol. 2010 Jun;8(6):530-4. doi: 10.1016/j.cgh.2010.03.004