Тромботические микроангиопатии: гемолитико-уремический синдром (ГУС) и тромботическая тромбоцитопеническая пурпура (ТТП)
Тромботическая микроангиопатия
1) тромбоцитопения
2) микроангиопатическая гемолитическая анемия (МАГА, неиммунная гемолитическая анемия с шистоцитами);
3) микроваскулярный тромбоз концевых артериол и капилляров с множественной дисфункцией органов.
Повреждение эндотелия сосудов при ТМА индуцирует процесс образования внутрисосудистых тромбоцитарных тромбов мелких сосудов. Потребление тромбоцитов приводит к развитию тромбоцитопении, сужение просвета сосудов вызывает микроангиопатическую гемолитическую анемию (происходит механическое разрушение эритроцитов), ишемию важнейших органов. Морфологически тромботическая микроангиопатия (ТМА) определяется как уплотнение сосудистой стенки с набуханием или отделением эндотелиальных клеток от базальной мембраны и отложением гиалиновых депозитов в субэндотелиальном пространстве, внутрисосудистые тромбоцитарные тромбы и окклюзия сосудов.
Классификация тромботических микроангиопатий
1. Первичные формы ТМА:
Тромботическая тромбоцитопеническая пурпура (ТТР)
-
врожденная
-
приобретенная
Гемолитико-уремический синдром (ГУС):
-
типичный ГУС
-
атипичный ГУС (аГУС)
-
приобретенные формы (80-90%): инфекционно-обусловленные (STEC-ГУС, Shigella, Streptococcus pneumoniae и т.д.), анти-CFH антитела (аГУС)
-
наследственные или семейные формы (10-20%): аберрации генов комплемента (аГУС)
2. Вторичные формы ТМА, ассоциированные с:
-
аутоиммунными заболеваниями
-
инфекциями
-
беременностью
-
трансплантацией органов
-
трансплантацией гемопоэтических стволовых клеток
-
метилмалоновой ацидемией (дефектный метаболизм кобаламина C)
-
злокачественными новообразованиями
-
злокачественной гипертензией
-
лекарствами (циклоспорин, такролимус, сиролимус, эверолимус, гемцитабин, митомицин, бевацизумаб, сунитиниб, бортезомиб, карфилзомиб, адалимумаб, клопидогрел, симвастатин, эстрогены, прогестагены и др.)
Ряд исследователей относят к ТМА возникающий при беременности HELLP-синдром (H – гемолиз, EL – повышение печеночных ферментов, LP – низкое количество тромбоцитов).
Инфекционные агенты, ассоциированные с развитием ТМА:
1) Шига-токсин продуцирующие диарогенные инфекции:
-
Escherichia coli O157:H7, O26, O80, O91, O103, O104, O111, O121, O145
-
Shigella dysenteriae тип 1
2) Не продуцирующие шига-токсин диарогенные инфекции:
-
Норовирус
-
Clostridium difficile
-
Campylobacter upsaliensis
3) Респираторные инфекции:
-
Streptococcus pneumoniae
-
Haemophilus influenzae
-
Bordetella pertussis
4) Другие бактериальные инфекции:
-
лептоспироз
-
риккетсиоз
5) Вирусные инфекции:
- ВИЧ, CMV, EBV, VZV, грипп, гепатит A, В, С, вирус коксаки B, вирус денге, HHV 6, парвовирус B19
6) Паразитарные инфекции:
- малярия (Plasmodium falciparum)
Гемолитико-уремический синдром
Гемолитико-уремический синдром (ГУС, болезнь Гассера) – тромботическая микроангиопатия, встречающаяся преимущественно в детской популяции и является самой частой причиной развития острого повреждения почек (ОПП) у детей. ГУС характеризуется триадой признаков:
-
Кумбс-негативная микроангиопатическая гемолитическая анемиея (МАГА)
-
тромбоцитопения
-
острое повреждение почек
Большинство случаев (до 90%) ГУС возникают в результате инфицирования бактериями, продуцирующими шига-токсин (Stx): энтерогеморрагической Escherichia coli (STEC, Shiga toxin-producing E. coli) или Shigella dysenteriae type 1. Данная форма ТМА называется типичным ГУС или STEC-ГУС. Острая кишечная инфекция, вызванная этими штаммами бактерий, осложняется ГУС в 10-15% случаев. STEC-ГУС является одним из наиболее распространенных заболеваний, требующих экстренной заместительной почечной терапии (ЗПТ) у детей. Летальность при типичном ГУС во всем мире в период острой фазы достигает 2-5%.
Остальные 10% случаев ГУС, не относящиеся к типичному ГУС, обычно обозначаются термином атипичный ГУС (аГУС). Однако следует понимать, что аГУС – это не одно, а множество различных заболеваний со схожими клиническими признаками. В большинстве случаев аГУС представляет собой генетически-опосредованную системную ТМА, обусловленную хронической неконтролируемой активацией альтернативного пути комплемента. аГУС характеризуется рецидивирующим течением на протяжении всей жизни и представляет собой потенциально жизнеугрожающее состояние. Молекулярная диагностика аГУС в настоящее время включает в себя поиск патогенных вариантов в генах CFH, CD46/MCP, CFI, C3, CFB, THBD, CFHR1-5 и DGKE.
Эпидемиология ГУС
Чаще всего STEC-ГУС встречается у детей в возрасте 6 мес. - 5 лет, хотя заболеваемость этой формой ТМА может отмечаться в любом возрасте. Заболеваемость среди детей до 6 лет составляет около 6,1:100000. Среди взрослых заболеваемость составляет 0,5 на 100000 в год.
По данным различных исследований заболеваемость аГУС в Европе составляет 0,23–1,9 случаев на 1000000 в год. В Российской Федерации точных статистических данных нет. Заболеваемость аГУС составляет около 0,8 на 1000000 детского населения в год.
Патогенез ГУС
1. Патогенез типичного ГУС
Большинство случаев (до 90%) ГУС возникают в результате инфицирования бактериями, продуцирующими шига-токсин (Stx): энтерогеморрагической Escherichia coli (STEC) или Shigella dysenteriae type 1. Данная форма ТМА называется типичным ГУС или STEC-ГУС. Острая кишечная инфекция, вызванная этими штаммами бактерий, осложняется ГУС в 10-15% случаев.
Основным резервуаром STEC-инфекции является крупный рогатый скот, а переносчиками могут быть также овцы, козы, лошади, олени, кошки, собаки, птицы и мухи. Причина заражения – бактериальная контаминация воды, мясных и молочных продуктов. Возможна передача инфекции при контакте с животными, а также от человека к человеку и от матери ребенку. STEC–ГУС чаще встречается летом и осенью.
В основе патогенеза ГУС лежит повреждение эндотелия из-за воздействия шига-токсина (Stx). После заражения патогенные E.coli связываются с ворсинками терминального отдела подвздошной кишки и эпителием Пейеровых бляшек, затем происходит колонизация толстой кишки. Бактерии адгезируются к эпителиальным клеткам посредством мембранного белка интимина. Stx играет роль в усилении адгезии E.сoli к эпителию за счет увеличения экспрессии нуклеолина, другого поверхностного рецептора интимина. По мере постепенного повреждения кишечных ворсинок, развивается сначала диарея калового характера, позже гемоколит.
В кровотоке свободный Stx не обнаруживается. Его транспортерами служат полиморфноядерные нейтрофилы, моноциты, эритроциты, тромбоциты, а также тромбоцитарно-моноцитарные и тромбоцитарно-нейтрофильные комплексы. Количество связанного Stx коррелирует с выраженностью почечного повреждения. Нормальные энтероциты не экспрессируют Gb3. Считается, что Stx перемещается через плотное соединение кишечного эпителия за счет связывания с Gb3, экспрессируемых на клетках Панета, которые располагаются в глубоких криптах тонкого кишечника. На клеточном уровне Stx связывается с Gb3, который локализован на клетках гломерулярного эндотелия, мезангиальных клетках, подоцитах, клетках канальцевого эпителия, также он представлен и в других органах, особенно в большом количестве в нейронах и глиальных клетках головного мозга. После этого активная часть Stх, внедряясь в клетку, блокирует синтез белков, вызывая апоптоз клеток.
Эндотелий микроциркуляторного русла более подвержен воздействию Stx в сравнении с более крупными сосудами. В результате Stx-опосредованные изменения эндотелиального фенотипа приводят к протромбогенному эффекту.
Еще одним патогенным фактором STEC является липополисахарид клеточной стенки бактерии (О157LPS), связанный в кровотоке с тромбоцитами, моноцитами и нейтрофилами. Связывание O157LPS с тромбоцитами приводит к активации и агрегации последних, а Stx присоединяется к активированным тромбоцитам и моноцитам.
Активация комплемента при STEC-ГУС рассматривается как механизм «второго удара», который усиливает повреждение эндотелия микроциркуляторного русла.
2. Патогенез атипичного ГУС
Около 10% случаев ГУС, не относящиеся к типичному ГУС, обычно обозначаются термином атипичный ГУС. Однако следует понимать, что аГУС – это не одно, а множество различных заболеваний со схожими клиническими признаками. В большинстве случаев аГУС представляет собой генетически-опосредованную системную ТМА, обусловленную хронической неконтролируемой активацией альтернативного пути комплемента. аГУС характеризуется рецидивирующим течением на протяжении всей жизни и представляет собой потенциально жизнеугрожающее состояние.
Нарушения, лежащие в основе развития аГУС, касаются альтернативного пути активации системы комплемента. В отличие от классического и лектинового путей, активация которых начинается после связывания с иммунными комплексами или микроорганизмами, альтернативный путь находится в состоянии постоянной активации, исходный уровень которой низок (т.н. механизм «холостого хода»), что обеспечивается спонтанным гидролизом С3 компонента комплемента. Образующийся при этом фрагмент С3b может связываться как с патогенами, так и с собственными клетками организма. На чужеродной (например, бактериальной) поверхности С3b связывается с фактором В (CFB), в результате чего образуется С3-конвертаза (комплекс С3bВb). Последняя многократно усиливает расщепление С3 за счет формирования так называемой «петли амплификации». При присоединении к С3-конвертазе дополнительных фрагментов С3b образуется С5-конвертаза (С3bВb(С3b)) – энзиматический комплекс, расщепляющий С5-компонент комплемента. При расщеплении С5 образуется С5b фрагмент, запускающий сборку мембраноатакующего комплекса С5b-9 (МАК), который вызывает лизис бактериальных клеток.
Поверхность клеток хозяина в норме защищена от локальной амплификации и накопления С3b. Эту защиту обеспечивает жесткий контроль со стороны ряда регуляторных факторов комплемента, представленных как плазменными, так и мембраносвязанными белками, фиксированными на поверхности эндотелиальных клеток. Основными плазменными протеинами, регулирующими альтернативный путь активации комплемента, служат факторы Н (CFH) и I (CFI), мембраносвязанными – мембранный кофакторный протеин (CD46/MCP) и тромбомодулин (THBD), взаимодействие которых приводит к преобразованию C3b в неактивную молекулу iC3b, блокируя тем самым ключевой механизм активации – образование больших количеств С3-конвертазы с последующим образованием МАК (С5b-9).
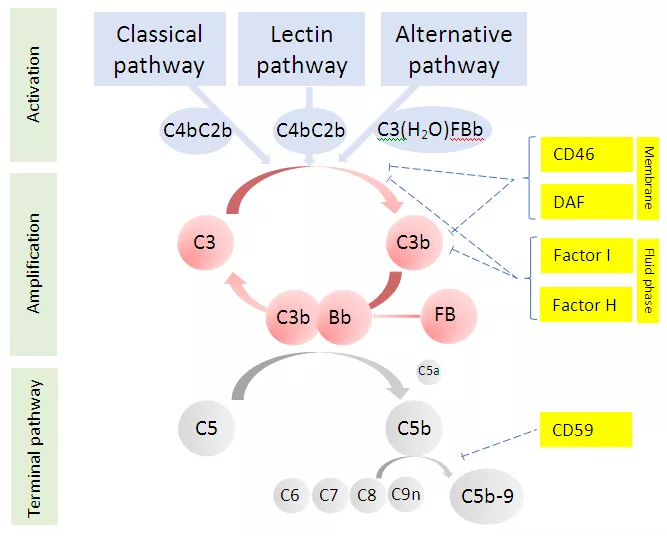
Рис 1. Активация и регуляция системы комплемента
CFH – основной регуляторный фактор альтернативного пути активации комплемента. Он блокирует образование С3-конвертазы и напрямую ускоряет ее распад. Кроме того, фактор Н является кофактором CFI в инактивации C3b, которая приводит к образованию неактивного фрагмента iC3b, неспособного связываться с фактором В для образования С3-конвертазы. Таким образом, CFH принадлежит ключевая роль в защите эндотелиальных клеток от активации комплемента. Кроме того, установлено важное значение CFH в регуляции функции тромбоцитов за счет блокировки активации комплемента на их поверхности, что, в свою очередь, приводит к уменьшению функциональной активности и способствует снижению риска тромбообразования.
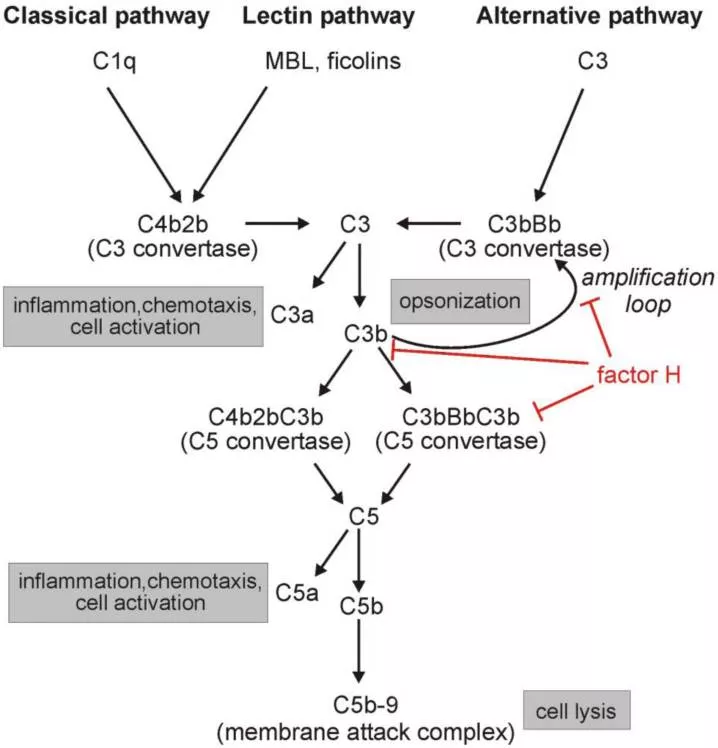
Рис 2. Ингибирующая роль фактора H (CFH)
Наряду с наиболее часто встречающимися аберрациями в генах белков-регуляторов, приводящими к нарушению их функции по контролю за активностью альтернативного пути комплемента (loss-of-function), описаны также аберрации в генах фактора В (CFB) и С3 компонента комплемента, обеспечивающие значительное нарастание активности (gain-of-function) за счет стабилизации С3-конвертазы и её резистентности к инактивации, что вызывает избыточную активацию системы комплемента.
Предполагается, что имеющиеся у пациентов с аГУС аберрации в генах, кодирующих регуляторные белки, приводят к нарушению защиты эндотелиальных клеток от активации системы комплемента вследствие дефицита или, чаще, функциональных нарушений этих белков. В результате этого на поверхности клеток эндотелия усиливается образование МАК, вызывающее их повреждение с обнажением субэндотелиального матрикса и последующим образованием тромбов.
Преимущественное поражение почек при аГУС, по-видимому, обусловлено особенной чувствительностью фенестрированного гломерулярного эндотелия к повреждению, обусловленному нарушенной регуляцией комплемента.
Молекулярная
диагностика аГУС сложна и включает в настоящее время выявление патогенных
вариантов в генах CFH, CD46/MCP, CFI, C3, CFB, THBD, CFHR1-5 и DGKE, поиск
гаплотипов с высоким риском (CFH-CFHR3 и MCPggaac) и определение количества
копий вариации, гибридные гены и другие сложные геномные перестройки в геномной
области CFH / CFHRs.
Тест 01.02.05.805. Молекулярно-генетическое исследование при наследственной форме атипичного гемолитико-уремический синдром (аГУС) и С3-гломерулопатиях (гибридные структуры, делеции и дупликации генов CFH, CFHR1, CFHR2, CFHR3, CFHR4 и CFHR5, CD46 и CFI)
aГУС ассоциирован с патогенными вариантами в гене CFH у 20-30 % пациентов, MCP у ≈8-10%, CFI – у ≈6%, CFB – у ≈10%, C3 – у 6-10%, THBD – 3-5%. Около 12% пациентов с аГУС имеют аберрации двух и более генов системы комплемента.
Ген CFH существует в кластере генов (кластер регуляторов активации комплемента) вместе с пятью высоко-гомологичными генами, кодирующими белки, связанные с фактором H (CFHR1–5). Аберрации в этих генах могут встречаться с частотой 3-10%.
Аберрации в генах CFH, CFI, THBD и C3 преобладают у пациентов младше 1 года, в возрасте 1 года и старше помимо вышеописанных аберраций выявляются патогенные варианты MCP. У детей с манифестацией в возрастном интервале между 7 и 11 годами чаще определяются антитела к CFH.
Более чем у 10% пациентов с аГУС, преимущественно у детей, выявляют аутоантитела к CFH – основному регуляторному протеин у альтернативного пути комплемента, наличие которых приводит к тем же последствиям, что и аберрациии. «Антительный» аГУС склонен к частому рецидивированию.
В 30-48% случаев aГУС в настоящее время не находит должного объяснения с позиций молекулярной генетики. Однако данная группа пациентов демонстрирует аналогичную тяжесть заболевания с рецидивирующим характером течения, как и при аГУС с генетически подтвержденной природой заболевания.
аГУС носит семейный характер у ≈25% пациентов. Спорадические случаи аГУС имеют лучший прогноз, чем семейные формы. Неотягощенный семейный анамнез не исключает возможности генетической передачи заболевания. Лишь половина носителей мутации в семье в течение жизни имеют манифестацию заболевания.
В ряде случаев при молекулярно-генетическом тестировании выявляются аберрации в генах, не связанных с комплементом (DGKЕ, INF2, PLG), а также аберрации в генах, приводящие к дефектному метаболизму кобаламина C (MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE).
В настоящее время установлено, что генетические аномалии комплемента, которые раньше рассматривали как основную причину развития аГУС, являются лишь фактором, предрасполагающим к возникновению ТМА. Для реализации этой предрасположенности требуются дополнительные факторы, которые могут оказать влияние на развитие или прогрессирование аГУС. Такими факторами, инициирующими дополнительную активацию комплемента у предрасположенных лиц и потому называемыми комплемент-активирующими состояниями, служат инфекции дыхательных путей (18% случаев), желудочно-кишечного тракта (24%), беременность (7%), трансплантация органов (5%) и пр. Вакцинации отводится второе место среди причин, провоцирующих развитие аГУС (только у детей, имеющих генетический дефект). Почти у 1/3 пациентов с аГУС триггерные факторы идентифицировать не удается.
Клиническая картина ГУС
1. Клиническая картина типичного ГУС
Типичный ГУС развивается в основном у детей в возрасте от 6 месяцев до 5 лет. В анамнезе имеются указания на текущий или предшествующий эпизод инфекционного процесса в виде повышения температуры, наличия жидкого стула с примесью крови с последующим развитием слабости, снижения аппетита/отказа от еды, повторной рвоты, резкой бледности, иногда – с элементами кожных геморрагий, уменьшение объема мочи/отсутствие мочи, симптомы интоксикации, связанные с ОПП, отеки (периферические, полостные), иногда – макрогематурия.
К факторам риска развития ГУС при STEC-инфекции помимо возраста относят женский пол, обезвоживание, лихорадку, рвоту, лейкоцитоз, гемоколит, использование антикислотных препаратов (ингибиторов протонного насоса, антогонистов Н2-рецепторов), антибиотиков (β-лактамы, фторхинолоны) и антиперистальтических препаратов в продромальный период.
В течении STEC-ГУС выделяют продромальную фазу и период развернутой клинической картины. Продромальный период характеризуется диареей у 90-95% пациентов, рвотой – у 30-60%, абдоминальным синдромом. Через 1-2 дня в 70% случаев развивается гемоколит.
STEC-ГУС манифестирует через 2-14 дней (в среднем на 6-й день) от начала диареи. Характерно ухудшение общего состояния ребенка, нарастание вялости, возникновение бледности и иктеричности кожи, пастозности век и голеней. Возможен геморрагический синдром, проявляющийся петехиальной сыпью, экхимозами, носовыми и желудочно-кишечными кровотечениями. У 5–10% пациентов со STEC-ГУС дебют заболевания не связан с предшествующей диареей в анамнезе, что подчеркивает важность проведения микробиологического исследования у всех пациентов с ТМА независимо от истории болезни.
Для STEC-ГУС характерно быстрое развитие олигурии или анурии, возможно изменение цвета мочи за счет гематурии и/или гемоглобинурии. Олигоанурическое ОПП, требующее проведения ЗПТ, развивается примерно у 50-60% пациентов. Как правило, на фоне энтеральных потерь анурия диагностируется поздно.
В остром периоде STEC-ГУС в 72% случаев встречается артериальная гипертензия, связанная с гипергидратацией, отличающаяся упорным течением и плохим ответом на терапию. При восстановлении диуреза отмечается второй подъем артериального давления, связанный с повышенной выработкой ренина. Перегрузка объемом, электролитные нарушения, токсический миокардит при ОПП и кардиальная ТМА служат причиной сердечной недостаточности у части пациентов в остром периоде STEC-ГУС.
Поражение ЦНС развивается в 25% пациентов и проявляется психомоторным возбуждением или угнетением, фокальными или генерализованными судорогами, нарушениями сознания различной степени выраженности. Коагулопатия потребления и АГ могут привести к геморрагическому инсульту.
Почки и мозг являются органами, наиболее уязвимыми для STEC-ГУС, но описаны поражения других органов, которые необходимо учитывать при оценке пациентов с данной патологией.
Со стороны ЖКТ, как правило, отмечаются проявления энтероколита различной степени тяжести (от незначительного учащения и разжижения стула до профузной кровавой диареи с резкими болями в животе). В некоторых случаях развивается язвенный энтероколит с некрозом и перфорацией кишечной стенки, что обуславливает необходимость оперативного вмешательства. Возможно выявление гепатоспленомегалии.
2. Клиническая картина атипичного ГУС
аГУС может манифестировать в любом возрасте, начиная с неонатального периода. Возможен дебют с неспецифических симптомов – слабости, утомляемости, общего недомогания, гриппоподобного синдрома. У детей дебют аГУС чаще всего связан с комплемент-активирующим состоянием: диарейным гастроэнтеритом (23-28%), острым респираторным заболеванием (18%), вакцинацией (вакцины, содержащие живые аттенуированные вирусы, вакцины с иммуноадъювантами), травмой, хирургическим вмешательством и др. В 31% случаев аГУС начинается внезапно. У взрослых пациентов в 20% случаев отмечается стертое начало с медленным прогрессированием.
Клиническая картина аГУС характеризуется значительным полиморфизмом симптомов. Однако основными проявлениями болезни являются тромбоцитопения, МАГА и ОПП, составляющие классическую триаду ТМА. Не исключается (в 20% случаев) стертое начало аГУС с медленным прогрессированием. При этом на протяжении нескольких недель или даже месяцев отмечаются слабо выраженная анемия, транзиторная тромбоцитопения, и сохранная функция почек. Возможно также развитие «неполной» ТМА с отсутствием тромбоцитопении (13-40%) или, реже, МАГА (6%). В ряде случаев описано развитие только почечных признаков ТМА в отсутствие гематологических нарушений.
Также при аГУС возможно относительно постепенное развитие ТМА на фоне гастроэнтероколита (возможен гемоколит) со снижением почечных функций в течение нескольких дней, рецидивирующие эпизоды неврологических нарушений (очаговые симптомы, спутанность сознания, транзиторные ишемические атаки).
В большинстве случаев поражение почек манифестирует острым поражением почек с наличием олиго/анурии или без нее. В 30-50% случаев при развитии ОПП при аГУС не отмечается снижение диуреза, иногда может быть макрогематурия. В 17% случаев патологический процесс в почках характеризуется протеинурией, гематурией без развития признаков ОПП. Заболевание может также дебютировать изолированной протеинурией с признаками начальной ХБП. Половина детей и большинство взрослых пациентов с аГУС нуждаются в проведении ЗПТ в момент госпитализации. Следует отметить, что при aГУС ОПП может не быть первым проявлением болезни.
Артериальная гипертнезия развивается у большинства пациентов вследствие перегрузки объемом при наличии олиго/анурии и/или гиперренинемии из-за ишемии ткани почек, обусловленной ТМА.
Генерализованный характер ТМА при аГУС обусловливает развитие экстраренальных признаков болезни, связанных с поражением микроциркуляторного русла различных органов и систем, в том числе головного мозга, сердца, лёгких, ЖКТ, органа зрения. Внепочечные проявления заболевания наблюдаются у 20% пациентов.
У большинства пациентов имеется выраженный отечный синдром, основными проявлениями которого служат массивные периферические отеки вплоть до анасарки и выпот в полостях (гидроторакс, гидроперикард, асцит). Причиной отеков является резко повышенная сосудистая проницаемость, индуцированная С3а и С5а компонентами комплемента через освобождение больших количеств гистамина.
Почти у половины пациентов диагностируется поражение ЦНС разной степени выраженности (сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегия, ступор, кома). В ряде случаев возможно развитие отека головного мозга, обусловленное повышенной сосудистой проницаемостью.
У 40% пациентов развивается ТМА миокарда, основным проявлением которой может быть дилатационная кардиомиопатия с признаками постепенно нарастающей или острой сердечной недостаточности. Небольшое число (около 3%) пациентов с интрамиокардиальной ТМА демонстрирует развитие острого инфарктa миокарда, который может стать причиной внезапной смерти.
Легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома взрослых. Достаточно часто у пациентов с аГУС развиваются двусторонние инфильтраты в легких, что затрудняет верификацию диагноза и требует дифференциальной диагностики с васкулитами и инфекционной патологией.
Поражение ЖКТ встречается приблизительно у 30% пациентов с аГУС. Наиболее часто наблюдается поражение кишечника, проявляющееся диареей, тошнотой и рвотой, хотя возможно развитие абдоминального болевого синдрома. Нередко отмечается развитие острого панкреатита с характерными клиническими признаками вплоть до панкреонекроза. Описано острое развитие сахарного диабета. Реже наблюдаются ишемические некрозы печени.
Также, в ряде случаев, диагностируется поражение органа зрения в виде пурчероподобной ретинопатии, проявляющейся преимущественного билатеральным повреждением органа зрения с отеком диска зрительного нерва, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком. В настоящее время наиболее принятой теорией является микроэмболизация сосудистой сети сетчатки, приводящая к прекапиллярной окклюзии артериол и микрососудистому инфаркту слоя нервных волокон.
Редким проявлением аГУС является поражение кожи с развитием обширных некротических очагов. Встречается также ишемическая гангрена пальцев рук и ног, приводящая к ампутации.
Примерно у 6% пациентов отмечается полиорганная недостаточность, связанная с диффузной ТМА с поражением ЦНС, ишемией миокарда, легочным кровотечением и дыхательной недостаточностью, панкреатитом, печеночным цитолитическим синдромом, желудочно-кишечным кровотечением. Экстраренальные проявления TMA возникают как в острой фазе, так и после нее (спустя годы) в результате хронического нарушения функции комплемента и при сочетании с факторами повреждения клеток эндотелия (лекарства, гипертензия, облучение и др.). При этом надо помнить, что тяжелые экстраренальные проявления могут возникнуть при отсутствии явного рецидива заболевания и отклонений гематологических показателей, так как аГУС – хроническое заболевание, течение которого продолжается, даже если состояние пациента кажется стабильным.
Диагностика ГУС
В связи с тем, что все ТМА независимо от их патогенеза имеют сходные клинико-лабораторные проявления и общую гистологическую картину, чрезвычайно важной представляется дифференциальная диагностика между основными формами первичной ТМА – STEC-ГУС, аГУС и ТТП.
У детей в круг дифференциально-диагностического поиска, кроме STEC-ГУС, аГУС и ТТП, следует включать метилмалоновую ацидемию (дефект метаболизма кобаламина) и ГУС, ассоциированный с пневмококком. Таким образом, при диагностике ГУС первоначально необходимо установить наличие ТМА, в последующем – провести дифференциальную диагностику между первичными и вторичными ТМА.
1. Диагностика типичного ГУС (STEC-ГУС)
При развитии симптомов ТМА на фоне симптомов со стороны ЖКТ (диарея, тошнота, рвота, боли в животе, гастроэнтерит) необходимо исключить STEC-ГУС. Он устанавливается на основании характерной клинической картины с диареей и должен быть подтвержден лабораторными данными, исключающими другие ТМА.
Диагностика ТМА основана на наличии МАГА и тромбоцитопении в сочетании с признаками поражения почек и/или экстраренальными проявлениями.
Наличие МАГА устанавливают на основании выявления у пациентов Кумбс-негативной анемии, шизоцитов – фрагментированных эритроцитов в мазке периферической крови (диагностически значимое их содержание для ТМА >1%), повышения ЛДГ, снижения гаптоглобина. Гипербилирубинемия (за счет повышения непрямой фракции), свободный гемоглобин, ретикулоцитоз также являются неспецифическими индикаторами гемолиза эритроцитов.
Тромбоцитопению диагностируют при количестве тромбоцитов <150х109/л. Если число тромбоцитов превышает это значение, то об их потреблении можно судить по снижению количества тромбоцитов >25% от базального уровня (если он известен). В мазках периферической крови можно обнаружить гигантские тромбоциты, при трепанобиопсии костного мозга – нормальное количество мегакариоцитов.
У пациентов с МАГА и тромбоцитопенией наличие ОПП, изолированного или в сочетании с симптомами поражения ЖКТ, ЦНС, легких, сердца служит основанием для диагностики ТМА.
В случае констатации ТМА диагноз STEC-ГУС можно верифицировать, подтвердив инфекционную природу и исключив аГУС и ТТП.
Инфекционное обследование на STEC-ГУС показано при наличии симптомов со стороны ЖКТ. Известно, что у 5-10% пациентов может не быть предшествующей диареи, что подчеркивает важность микробиологического исследования всех пациентов с ТМА независимо от истории заболевания. Лабораторные исследования следует выполнять в первые сутки госпитализации пациента в стационар до начала антибактериальной терапии.
Инфекционное обследование при STEC-ГУС:
посев кала для выявления культуры STEC (на среду Mac Conkey для E.coli O157:H7)
выделение из клинического материала (кал/ректальный мазок) штаммов энтерогеморрагических E.coli методом ПЦР
определение Stx в сыворотке крови
определение в сыворотке крови антител к липополисахариду наиболее распространенного в данном регионе серотипа E.coli
ПЦР-анализ первичных фекальных культур является наиболее чувствительным и специфическим исследованием для скрининга организмов, продуцирующих токсины. Присутствие сывороточных антител IgM против специфического липополисахарида E.coli служит важным доказательством недавно перенесенной инфекции STEC.
STEC-ГУС всегда развивается остро. Волнообразное, рецидивирующее течение не характерно для данной формы ТМА. После первоначального падения гемоглобина и тромбоцитов постепенно их уровень нарастает, хотя признаки почечного повреждения могут сохраняться еще длительное время.
Критерии, позволяющие заподозрить/установить диагноз STEC-ГУС:
1. Отсутствие семейного анамнеза
2. Возраст дебюта ГУС: 6 месяцев – 5 лет
3. Развитие ГУС на фоне кишечной инфекции (признаки поражения ЖКТ, диарея, гемоколит)
4. Развитие ГУС во время вспышки инфекции STEC
5. МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина
6. Потребление тромбоцитов: тромбоциты <150х109/л или число тромбоцитов уменьшено˃25%, не выходя за границы нормы
7. Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, ЖКТ, органа зрения и др.
8. Положительный результат посева кала или наличие Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР
9. Активность ADAMTS13 > 10% (для исключения ТТП)
10. Нет изменений содержания ацилкарнитинов по данным тандемной масс-спектрометрии (исключение сblC-ГУС)
11. Безрецидивное течение
2. Диагностика атипичного ГУС
До настоящего времени специфические диагностические маркеры аГУС отсутствуют. Диагноз «аГУС» – это диагноз исключения. Он устанавливается на основании совокупности данных анамнеза, наличия/отсутствия триггерного события, характерной триады ТМА и должен быть подтвержден лабораторными данными, исключающими другие формы ТМА. Течение аГУС часто ассоциируется сочетанием ОПП с экстраренальными проявлениями. Клиническая настороженность в отношении аГУС необходима при наличии симптомокомплекса гастроэнтероколита у детей в возрасте < 6 месяцев, указаний на ранее необъяснимую анемию, стертое начало или относительно постепенное начало со снижением почечной функции в течение нескольких дней, волнообразное течения с повторными падениями уровня гемоглобина и тромбоцитов, подозрения на ранее перенесенный ГУС, семейных случаев ГУС в различное время.
В случае развития ТМА диагноз аГУС можно верифицировать, только исключив другие формы первичных и вторичных ТМА: STEC-ГУС, ТТП, пневмококк-ассоциированный ГУС (pnГУС) и и ГУС, обусловленный дефектным метаболизмом кобаламина (сblC-ГУС) – см. ниже.
Критерии, позволяющие заподозрить аГУС:
1. Возраст <6 мес. / >5 лет
2. У младенца ˂6 мес. негативный тест на присутствие метилмалоновой кислоты в моче, нормальный уровень метилмалонилкарнитина и пропионилкарнитина в крови по данным тандемной масс-спектрометрии (исключение сblC-ГУС)
3. Дебют ТМА без диареи, пневмококковой инфекции
4. Относительно постепенное начало на фоне гастроэнтероколита (возможен гемоколит) со снижением почечной функции в течение нескольких дней
5. Возможен семейный анамнез заболевания
6. Задержка развития
7. Эпизоды неврологических нарушений (очаговые симптомы, спутанность сознания и др.) при активности ADAMTS13 >10%
8. Симптомы заболеваний других органов (инфаркт миокарда, кардиомиопатия, боли в груди, одышка, дыхательная недостаточность, панкреатит, гепатит, колит и др.)
9. Ранее имевшиеся эпизоды ТМА/ГУС
10. МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина
11. Потребление тромбоцитов: тромбоциты ˂150х109/л или число тромбоцитов уменьшено˃25% от исходного, не выходя за границы нормы
12. Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, желудочно-кишечного тракта, органа зрения и др.
13. Развитие нефротического синдрома при отсутствии ОПП на фоне ТМА
14. ОПП без снижения диуреза
15. При наличии предшествующей диареи отрицательный результат Escherichia coli / Shigella dysenteriae type 1 в культуре фекалий методом ПЦР (исключение STEC-ГУС)
16. Активность ADAMTS13>10% (исключение ТТП)
17. ТМА с развитием ОПП и экстраренальных проявлений при условии, что последние не связаны с объемной перегрузкой
18. Отсутствие обратного развития ТМА на фоне плазмотерапии
19. Отсутствие признаков СКВ, АФС, эндотелиотоксичности лекарств
Критерии, свидетельствующие в пользу диагноза аГУС:
1. Отягощенный семейный анамнез: случаи аГУС в семье
2. Развитие ТМА после вакцинации, ОРЗ, травмы и без триггерного события
3. Развитие ТМА у пациентов с предшествующей диареей с отрицательным результатом тестов на Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР (исследование проводится до назначения антибиотиков)
4. Повторные эпизоды гемолиза и потребления тромбоцитов в период манифестации заболевания
5. Появление экстраренальных симптомов при разрешающейся ТМА
6. Рецидивы, разделенные периодами ремиссии и прогрессированием до ХБП 5.
7. Патогенные варианты генов, кодирующих белки комплемента, описанные при аГУС (тест 01.02.05.805).
Следует отметить, что отсутствие патогенных вариантов в генах, кодирующих белки комплемента не исклюет диагноза аГУС из-за возможности наличия патогенных вариантов в генах, отличных от классических генов аГУС и вариантов, которые могут быть пропущены при секвенировании (например, большие геномные перестройки или интронные варианты, не охваченные традиционным панельным тестированием).
8. Положительный клинико-лабораторный эффект комплемент-блокирующей терапии (экулизумаб).
Дифференциальная диагностика аГУС
STEC-ГУС;
ТТП;
Пневмококк-ассоциированный ГУС;
Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2;
Гемолитические анемии;
Пароксизмальная ночная гемоглобинурия;
Мегалобластная анемия;
Синдром Эванса;
Гемобластоз;
Гемофагоцитраный лимфогистиоцитоз;
Острый тубулоинтерстициальный нефрит;
Вторичные формы ТМА (СКВ, АФС, системная склеродермия, злокачественная гипертензия, лекарственно-ассоциированная ТМА и др.);
Редкие формы ГУС (DGKE, сblC-ГУС);
Сепсис
1) Диагноз STEC-ГУС может быть отвергнут на основании исключения наличия Stx в крови и отрицательных результатов Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР
2) Для исключения ТТП всем пациентам с ТМА необходимо определение активности металлопротеазы ADAMTS13. Исследование активности ADAMTS13 следует выполнять до проведения инфузии плазмы. Снижение её <10% свидетельствует в пользу ТТП, что требует в последующем выявления в крови анти-ADAMTS13-антител для верификации аутоиммунной формы заболевания и выбора тактики лечения. У пациентов с аГУС активность ADAMTS13 может быть снижена, однако её показатель всегда превышает 10%. Снижение активности ADAMTS13, помимо аГУС, может наблюдаться при системных заболеваниях (катастрофический АФС, СКВ), сепсисе, ДВС-синдроме. В случаях невозможности немедленного исследования активности ADAMTS13 у пациента с ТМА и крайней тяжестью состояния, обусловливающей угрозу жизни или высокий риск тяжелых почечных и/или внепочечных осложнений, следует использовать правило, в соответствии с которым значения креатинина сыворотки >150-200 мкмоль/л (1,7-2,3мг/дл) в сочетании с числом тромбоцитов >30х109/л практически исключают диагноз ТТП. Поскольку выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, в последнее время появились сведения о том, что при стабильной умеренной тромбоцитопении не ниже 70х109/л активность ADAMTS13 можно не определять.
3) ГУС, ассоциированный с Streptococcus pneumoniae (pnГУС), наиболее часто встречается у детей младше 2 лет и составляет около 5% всех случаев ГУС в педиатрической практике. В 72% случаев pnГУС развивается на фоне пневмонии и/или эмпиемы плевры, в 23% – менингита и в 5% – пневмококкового сепсиса. Ранее считалось, что основную роль в патогенезе pnГУС играет антиген Томсена–Фриденрейха (ТF-антиген), локализованный на поверхности эритроцитов, тромбоцитов, эндотелиалиальных клеток и клеток клубочков. Однако, в настоящее время доказано, что pnГУС может быть связан с потреблением комплемента на ранней стадии заболевания через альтернативный путь его активации.
Развивается pnГУС на 3-13 день течения инвазивной пневмококковой инфекции. Диагностическими особенностями pnГУС являются: развитие ОПП, тромбоцитопении и МАГА с положительной прямой пробой Кумбса (60-90%) при отсутствии лабораторных доказательств ДВС-синдрома. Для пациентов с pnГУС характерным является: длительная олигурия, развитие ОПП у всех пациентов с потребностью в ЗПТ в 40-80% случаев, а также наличие экстраренальных проявлений (молниеносная пурпура, панкреатит, холецистит, тромбозы, кардиопатия, глухота).
4) ГУС, ассоциированный с дефектным метаболизмом кобаламина (сblC-ГУС) – моногенное аутосомно-рецессивное заболевание. Известно 37 случаев ГУС, обусловленного дефектным метаболизмом кобаламина (сblC-ГУС) с манифестацией в возрасте до 1 года в 17 наблюдениях. Данная форма – редкий случай ТМА в детском возрасте, причиной которой является генетическое орфанное заболевание – метилмалоновая ацидемия. Дебют заболевания в 5% случаев у детей ≤1 года, в 25% - старше 1 года. Особенностями течения сblC-ГУС у детей с ранним началом (до 1 года) являются: трудности вскармливания (рвота, срыгивания, отказ от еды), развитие гипотрофии, поражение ЦНС (мышечная гипотония, летаргия, задержка развития, судороги, микроцефалия/гидроцефалия), нарушение зрения (пигментная ретинопатия/нистагм), тяжелая артериальная гипертензия. Летальный исход наступает у 100% детей без лечения. При поздней манифестации сblC-ГУС (у детей старше 1 года) характерно развитие легочной гипертензии (40%), поражение ЦНС (когнитивные нарушения, атаксия, судороги, миелопатия) и тяжелая гипертензия.
Диагностика сblC-ГУС основывается на выявлении МАГА, макроцитоза, ретикулоцитоза <3‰,тромбоцитопении с/без лейкопенией и нейтропенией, протеинурии с/без нефротического синдрома, гематурии, ОПП, прогрессирующей ХБП, тяжелого метаболического ацидоза с положительным анионным интервалом, гипергомоцистинемии, повышение уровня метилмалоновой кислоты в крови/моче (газовая хроматография), повышение уровня метилмалонилкарнитина и пропионилкарнитина (тандемная масс-спектрометрия) в крови, патологических вариантов в генах MUT, MMAA, MMAB, ММАСНС, ММАDHC, MCEE.
Таким образом, исключение STEC-ГУС, ТТП, pnГУС и сblC-ГУС у пациента с не вызывающей сомнений ТМА позволяет диагностировать аГУС. Кроме того, необходимо помнить, что в 20% случаев диагностируются неполные формы аГУС в виде диады симптомов вместо триады: сочетание МАГА с ОПП или тромбоцитопении с ОПП. Также и экстраренальные проявления аГУС могут отмечаться без лабораторных признаков ТМА у пациентов с уже установленным диагнозом.
Лабораторная диагностика ГУС
1) Клинический анализ крови с микроскопией, в т.ч. с исследованием фрагментированных эритроцитов (шизоцитов) и подсчетом ретикулоцитов.
2) Общий анализ мочи (гемоглобин, белок, микроскопическое исследование осадка мочи) с целью диагностики протеинурии, гематуриии, гемоглобинурии.
3) Исследование альбумин/креатининового соотношения в разовых порциях мочи для оценки клубочковой фильтрации.
4) Определение ДНК диарогенных эшерихий (ЕНЕС, ЕРЕС, ЕТЕС, EAgEC, EIEC) в образцах фекалий методом ПЦР – рекомендуется как пациентам с диареей, гемоколитом, так и пациентам с признаками поражения ЖКТ без диареи.
5) Бактериологическое исследование кала для выявления STEC-инфекции: микробиологическое (культуральное) исследование фекалий/ректального мазка на диарогенные эшерихии (ЕНЕС, ЕРЕС, ETEC, EAgEC, EIEC) с определением чувствительности к антибактериальным препаратам – рекомендуется как пациентам с диареей, гемоколитом, так и пациентам с признаками поражения ЖКТ без диареи.
6) Диагностика вирусных диарей (ротавирус, реовирус, аденовирус, астровирус, вирус Норволк, аденовирус и др.) методом ПЦР рекомендуется пациентам с признаками поражения ЖКТ без диареи / с диареей, пациентам с катаральным синдромом в сочетании с диареей для диагностики комплемент-активирующего состояния при аГУС.
7) Диагностика вирусных инфекций методом ПЦР, ИФА (грипп, аденовирус, ВПГ 1,2,6 типов, EBV, CMV) рекомендуется пациентам с признаками острой респираторной инфекции в продроме ТМА.
8) Прямой и непрямой антиглобулиновый тест (проба Кумбса).
Для STEC-ГУС, аГУС, ТТП, сblC-ГУС, вторичных форм ТМА характерна Кумбс-негативная анемия, при pnГУС – проба Кумбса положительная у 60-90% пациентов. При проведении непрямой пробы Кумбса оценивается наличие антиэритроцитарных антител, которые содержатся в свободном виде в плазме крови. Для исключения аутоиммунного характера гемолитической анемии необходимо проведение прямой пробы Кумбса, при которой определяются антиэритроцитарные антитела / компоненты комплемента, зафиксированные на поверхности эритроцитов крови. При положительной прямой пробе Кумбса необходимо исключать аутоиммунную гемолитическую анемию, синдром Фишера-Эванса.
9) Исследование уровня С3 и С4 фракции комплемента
У 60-80% пациентов с аГУС сывороточный С3 в пределах референсного диапазона. Нормальный показатель С3 не исключает диагноза аГУС, а выявленное снижение этого компонента комплемента может служить дополнительным аргументом в пользу этого диагноза. При STEC-ГУС может наблюдаться снижение уровня C4 в начале заболевания, с нормализацией после 10 дней, что указывает на активацию классического и/или лектинового путей, в которых происходит потребление C4.
10) Исследование уровня ЛДГ и гаптоглобина в сыворотке крови.
Гаптоглобин связывает свободный гемоглобин, высвобождающийся из разрушенных эритроцитов. Снижение уровня гаптоглобина при ТМА указывает на его избыточное потребление и является признаком усиленного гемолиза, причем именно внутрисосудистого, так как гемолиз вне кровяного русла понижением гаптоглобина не сопровождается. Гаптоглобин снижается при гемолизе раньше, чем повышается ЛДГ, являясь тем самым ранним маркером гемолиза. При нефротическом синдроме у пациентов без признаков гемолиза также может снижаться гаптоглобин из-за его потерь с мочой. На фоне тяжелого бактериального процесса уровень гаптоглобина может быть нормальным при активной ТМА, что связано с тем, что данный белок является острофазовым.
11) Исследование уровня прокальцитонина в крови (маркер сепсиса, системной воспалительной реакции).
12) Коагулограмма
13) Исследование активности ADAMTS13 в плазме крови в острый период заболевания пациентам с ТМА для диагностики/исключения ТТП.
Активность металлопротеазы оценивается до плазмотерапии. Значения активности ADAMTS13>10% исключает ТТП. При STEC-ГУС/аГУС активность металлопротеазы может быть как снижена, но выше 10%, так и быть в пределах референсного диапазона. Выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, поэтому при стабильной тромбоцитопении не ниже 70х109/л активность металлопротеазы можно не определять. Количество тромбоцитов крови>30х109/л и концентрация креатинина >200 мкмоль/л у пациента с ТМА практически исключает диагноз ТТП.
14) Исследование фактора Н системы комплемента
Фактор H – регуляторный белок альтернативного пути комплемента. Он необходим для поддержания гомеостаза системы комплемента и ограничения её активности. Фактор комплемента Н связывается с белком С3b и, ограничивая его функционирование, ускоряет распад С3-конвертазы, а также действует как кофактор фактора комплемента I (CFI). Он работает как в сыворотке, так и на поверхности клеток. Фактору Н принадлежит ключевая роль в защите эндотелиальных клеток от активации комплемента.
15) Определение антител к CFH в сыворотке крови всем пациентам с подозрением на аГУС с целью диагностики аутоиммунной формы заболевания.
Все пациенты с подозрением на аГУС должны быть обследованы на наличие антител к CFH в образцах крови, взятых до плазмаобмена или инфузии плазмы. Своевременное выявление анти СFH-антител имеет важное значение для выбора тактики лечения, поскольку их высокий титр требует в дополнение к комплемент-блокирующей терапии назначение иммуносупрессантов. При подтверждении антительной формы аГУС, требуется контроль анти-СFH-антител каждые 3-6 месяцев на фоне лечения в последующем до нормализации их уровня.
16) Определение С5а (анафилотоксина) компонента системы комплемента
С5 входит во все три пути активации комплемента и является общей конечной точкой, после активации которой происходит формирование мембрано-атакующего комплекса (MAC), вызывающего лизис клетки. C5a образуюется в результате разрезания компонента комплемента С5 на два фрагмента (второй фрагмент - C5b). Уровень С5а в плазме крови могут рассматриваться как интегральный показатель активации системы комплемента. В настоящее время показана принципиальная роль фактора комплемента С5 в патогенеза аГУС и возможность лечения данного заболевания путём использования анти-С5 моноклонального антитела экулизумаб.
17) Микробиологический посев крови на стерильность.
18) Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС.
19) Молекулярно-биологического исследования методом ПЦР (кровь, плевральный экссудат, спинномозговая жидкость) пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС.
20) Исследование уровня гомоцистеина, уровня витамина В12 и фолиевой кислоты в крови рекомендуется пациентам с ТМА при подозрении на генетически детерминированный дефицит кобаламина С.
Выявление повышенного уровня гомоцистеина при нормальных уровнях витамина B и фолиевой кислоты является вероятным признаком диагноза сblC-ГУС. Гипергомоцистеинемия также может быть диагностирована при тромбофилии, обусловленной мутацией генов фолатного цикла, дефиците витамина В12 и фолиевой кислоты.
21) Определение уровня витамина В12 (цианокобаламин) в крови рекомендовано пациентам с ТМА при длительной тромбоцитопении, подозрении на метилмалоновую ацидемию и мегалобластную анемию.
22) Тандемная масс-спектрометрия для определения содержания пропионилкарнитина (С3), свободного карнитина (С0) в крови, а также количественное определение 3-гидроксипропионовой, метиллимонной, 3-гидрокси-n-валериановой кислот в моче (комплексное определение содержания органических кислот в моче) и количественное определения уровня аминокислот (глицин, лейцин, изолейцин, валин, треонин) в крови рекомендуется всем пациентам с ТМА младше 6 мес. и пациентам независимо от возраста при подозрении на метилмалоновую ацидемию.
23) Определениеобщей гемолитической активности комплемента (СН50) рекомендуется только пациентам с аГУС при рецидивах и отсутствии эффекта от комплемент-блокирующей терапии (экулизумаб) с целью оптимизации режима введения и дозировок экулизумаба.
24) При
подозрении на атипичный ГУС рекомендовано проведение молекулярно-генетического
исследования методом секвенирования нового поколения (NGS) и секвенирования по
Сэнгеру для идентификации генетических мутаций, ассоциированных с аГУС (CFH,
MCP, CFI, C3, CFB, THBD, CFHR1, CFHR3, CFHR5). Для выявления делеций или
дупликаций проводится мультиплексная зависимая от лигирования амплификация
зонда (MLPA).
Тест 01.02.05.805. Молекулярно-генетическое исследование при наследственной форме атипичного гемолитико-уремический синдром (аГУС) и С3-гломерулопатиях (гибридные структуры, делеции и дупликации генов CFH, CFHR1, CFHR2, CFHR3, CFHR4 и CFHR5, CD46 и CFI)
В настоящее время рекомендуется проведение генетического анализа даже при наличии антител к CFH. Если мутация идентифицируется у пациента с антителами к CFH, решение о дальнейшем лечении должно приниматься индивидуально в каждом случае, в зависимости от титра антител и функциональных последствий мутации.
Кроме того, исследование необходимо провести всем пациентам, нуждающимся в трансплантации почки, независимо от формы ТМА; перед отменой терапии экулизумабоми для диагностики редких форм ТМА (ADAMTS13, DGKE, INF 2, PLG, MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE). В случаях, если причина ТМА не установлена, рекомендуется секвенирование всего экзома.
Тромботическая тромбоцитопеническая пурпура
Тромботическая тромбоцитопеническая пурпура (ТТП, болезнь Мошковица) – системная форма тромботической микроангиопатии, редкое жизнеугрожающее заболевание, характеризующееся неиммунной тромбоцитопенией потребления, возникающей вследствие тромбообразования в сосудах микроциркуляторного русла, неиммунной микроангиопатической гемолитической анемией, лихорадкой, почечной недостаточностью и неврологическими нарушениями. Причиной ТТП является недостаток активности ADAMTS13, который может быть обусловлен либо аберрацией в гене, либо наличием ингибирующих аутоантител к ADAMTS-13. В соответствии с этим ТТП подразделяется на врожденную формы (синдром Апшоу–Шульмана) и приобретенную (первичную или вторичную иммунноопосредованную форму).
Эпидемиология ТТП
В США ежегодно выявляется 3,1 случая ТТП на 1 млн. населения, а с учетом больных в ремиссии – 19 случаев на 1 млн. населения. Во Франции распространенность ТТП составляет 13 человек на 1 млн населения. Соотношение мужчины : женщины - 1 : 2, медиана возраста - 43 года. В Российской Федерации на настоящее момент данные о заболеваемости ТТП отсутствуют.
Врожденная форма заболевания (синдром Апшоу-Шульман) выявляется в 2,7% случаев, приобретенная форма ТТП - в 97,3%.
У детей ТТП является исключительной редкостью и соотношение врожденных и приобретенных форм принципиально отличается от такового у взрослых пациентов. По данным Французского регистра, ТТП за 15 лет было включено 74 ребенка, из них 29 пациентов (39%) - с врожденной формой ТТП.
Патогенез ТТП
ADAMTS13 – металлопротеаза, плазменный белок, который расщепляет сверхкрупные мультимеры фактора Виллебранда (vWF, ФВ) для регулирования чрезмерной его активности.
Фактора Виллебранда – ключевой компонент гемостаза, выделяется клетками в области сосудистого повреждения и оказывает протромботический эффект, усиливая адгезию и агрегацию тромбоцитов на поверхности эндотелиальных клеток. Мультимер ФВ синтезируется эндотелиальными клетками и высвобождается N-концом во внеклеточное пространство, оставаясь С-концом связанным с мембраной эндотелиальной клетки. Отщепленные фрагменты мультимера ФВ тоже обладают адгезивными свойствами, причем активность ФВ тем выше, чем больше мономеров включено в его состав. Наибольший протромботический эффект оказывают сверхкрупные мультимеры молекулы ФВ. ADAMTS-13 способна отщеплять фрагменты ФВ как от трансмембранной, так и от плазменной формы мультимера. Таким образом, ADAMTS-13 необходима, во-первых для высвобождения vWF в плазму, а во-вторых для регулирования его чрезмерной активности.
Недостаток активности ADAMTS-13 приводит к развитию ТТП. В этом случае мультимеры ФВ остаются заякоренными на мембране эндотелиальной клетки, а концентрация в ФВ в плазме остается низкой. В свою очередь тромбоциты адгезируются на этих «заякоренных» мультимерах ФВ, и в результате в неповрежденных сосудах происходит тромбообразование.
Образующиеся при ТТП тромбы состоят из тромбоцитов и ФВ, в них содержится очень небольшое количество фибрина, поскольку в процессе тромбообразования при ТТП не происходит активации свертывания и отложения фибрина. Тромбы при ТТП могут возникают во всех тканях, но реже образуются в легких и печени, поскольку циркуляция крови в этих органах происходит в условиях низкого давления, недостаточного для усиления связывания ФВ с тромбоцитами. Повреждения наблюдаются часто в таких органах, как сердце, поджелудочная железа, почки, мозг, однако в этих органах, как правило, выявляются относительно небольшие зоны некрозов, что свидетельствует, что повреждения при ТТП персистируют недолго и этого времени не достаточно для формирования некрозов. Транзиторной окклюзией объясняется и перемежающаяся неврологическая симптоматика, часто возникающая у больных ТТП. Тромбы при ТТП вызывают частичную окклюзию сосудов, позволяя эритроцитам проскальзывать мимо них. Эритроциты, перемещаясь по ригидным частично окклюзированным сосудам, подвергаются разрушению, что является причиной механического гемолиза и появления шистоцитов при ТТП.
Клиническая симптоматика возникает при ТТП, если плазменная активность ADAMTS13 составляет менее 10%. В то же время в ряде случаев больные, у которых активность ADAMTS13 менее 10%, в течение длительного времени могут не иметь клинических проявлений заболевания, а с другой стороны, у некоторых больных, у которых в результате лечения достигнут полный гематологический ответ, активность ADAMTS13 остается также ниже 10%. Подобный феномен регистрируется прежде всего при врожденной форме ТТП, в этих случаях необходим триггер, который запускает клинические проявления заболевания. Наиболее частыми триггерами являются:
Ревматологические заболевания
Алкоголь
Беременность
Воспаление
Травма
Хирургическое вмешательство
Выделяют врожденную и приобретенную формы заболевания. Приобретенная форма делится на первичную иммуноопосредованную и вторичную иммуноопосредованную.
При первичной иммуноопосредованной ТТП не выявляются заболевания или причины, вызвавшие образование аутоантител к ADAMTS13.
При вторичной иммуноопосредованной ТТП выявляются заболевания (системная красная волчанка, ВИЧ, инфекция и др.) или другие причины (беременность, лекарственные препараты и др.), приведшие к образованию антител к ADAMTS13
Системная красная волчанка (СКВ) может быть причиной возникновения приобретенной формы ТТП. У некоторых больных СКВ течение заболевания со временем осложняется ТТП и, наоборот, у больных с ТТП могут возникнуть симптомы, характерные для СКВ или других аутоиммунных заболеваний. Частота аутоиммунных нарушений, выявляемых у больных ТТП, среди которых СКВ, синдром Шегрена, аутоиммунный тиреоидит, синдром Рейно, антифосфолипидный синдром, псориаз и др., составляет 21,5%.
Причиной врожденной формы ТТП является мутация гена ADAMTS13. Врожденная форма ТТП или синдром Апшоу-Шульмана — это генетически детерминированное аутосомно-рецессивное заболевание, при котором «дефектный» ген ADAMTS13 унаследован от обоих родителей. Врожденная форма ТТП обычно манифестирует в неонатальном периоде тромбоцитопенией, анемией и желтухой. После обменных переливаний крови, трансфузий плазмы ремиссия может быть достигнута на длительный срок, а рецидивы заболевания провоцируются вакцинацией, инфекцией, хирургическими вмешательствами и т.д. Встречается хроническая рецидивирующая форма заболевания, при которой рецидивы возникают каждые 3-4 недели.
При синдроме Апшоу-Шульмана в гене ADAMTS13чаще всего выявляют миссенс-мутации (55%) или сдвиг рамки считывания (28%), реже – нонсенс-мутации, вставки или делеции нуклеотидов, мутации сплайсинга. Некоторые мутации могут приводить к нарушению секреции ADAMTS13, в этом случае будут наблюдаться как низкая плазменная активность ADAMTS13, так и низкая концентрация антигена ADAMTS13 в крови. При других мутациях секреция ADAMTS13 не нарушена, но секретируемый фермент обладает низкой протеиназной активностью, в этих случаях низкая плазменная активность ADAMTS13 будет сочетаться с нормальной или незначительно сниженной концентрацией антигена ADAMTS13. Синдром Апшоу-Шульмана следует заподозрить у пациента с клиническими проявлениями ТМА, у которого не определяется или очень низкая активность ADAMTS13, не выявляются ингибирующие ADAMTS13 антитела, диагноз установлен в детском возрасте либо заболевание дебютировало у женщины во время первой беременности.
Клиническая картина ТТП
Клиническая картина ТТП характеризуется острым началом и классически описывается в виде симптомов и синдромов, составляющих классическую пентаду, описанную в 1966 г. E.L. Amorosi и J.E. Ultman: лихорадка, тромбоцитопения, микроангиопатическая гемолитическая анемия, почечная дисфункция, неврологические нарушения. Однако все эти признаки в совокупности встречаются лишь у 7 % пациентов.
Лихорадка регистрируется у 28 % пациентов при обострении заболевания, температура тела поднимается выше 37,5°C, не связана с инфекционными осложнениями.
Тромбоцитопения при обострении заболевания выявляется у всех пациентов, носит неиммунный характер и является тромбоцитопенией потребления. Тромбоцитопения, как правило, выраженная (10-30 х 109/л), менее выраженное уменьшение количества тромбоцитов крови (> 30 х 109/л) чаще характерно для других форм тромботической микроангиопатии, хотя полностью не исключает ТТП. Клинически тромбоцитопения проявляется геморрагическим синдромом у 46 % пациентов в виде носовых кровотечений, синяков, петехий, десневых кровотечений, гематурии, меноррагий, кровоизлияний в сетчатку, кровохарканья.
Микроангиопатическая гемолитическая анемия в острой стадии заболевания встречается у всех больных, может сопровождаться желтухой.
Неврологические расстройства выявляются у 40-88% пациентов и могут варьировать от незначительных расстройств до серьезных нарушений. Головная боль регистрировалась у 25-42 % пациентов, когнитивные нарушения – у 28 %, фокальный дефицит – 24 – 29,7%, обмороки – у 11-12%, судороги – у 8-36,9%%, потеря зрения – у 6,3-8%, инсульт - у 6%, гемипарез – у 12,7 %, кома – у 4-12 %. Неврологические симптомы чаще всего обусловлены ишемией, но могут быть вызваны и кровоизлияниями.
Почечная дисфункция возникает у 10 – 75 % пациентов, причем, как правило, нетяжелая, чаще встречается у пожилых пациентов. Креатинин у большинства пациентов колеблется от 0,9 до 1,4 мг/дл. У 58,7 % пациентов развивается острое повреждение почек. У 27,4 % пациентов развивается нефротический синдром, гематурия и выявляется у 6% - 41,3%, лейкоцитурия – у 36,4 %, олигурия / анурия - у 3%.
Помимо классической пентады у пациентов с ТТП выявляется поражение и других органов.
Поражение сердца. Признаками поражения сердца встречаются у 24% пациентов, признаки инфаркта миокарда – 4,2 - 15,3 %.
Поражение желудочно-кишечного тракта. На боли в животе, как один из первых синдром ТТП, предъявляют жалобы 23,5-25 % пациентов, на диарею – 14 %. Клинически панкреатит вследствие ТТП диагностируется редко, однако при аутопсии поражение поджелудочной железы выявляется в 96 % случаев.
Диагностика ТТП
Диагноз ТТП основывается на совокупности клинических симптомов и лабораторных показателях, характерных для всех форм тромботической микроангиопатии (микроангиопатическая гемолитическая анемия, тромбоцитопения потребления, органная дисфункция), и выявлении сниженной <10% активности в плазме крови ADAMTS13.
Диагностика ТТП включает:
1) Клинический анализ крови. При ТТП выявляются:
анемия различной степени выраженности;
повышенное количество ретикулоцитов;
шистоциты >1%;
тромбоциты крови <150 х 109/л или уменьшение более чем на 25% от исходных значений. Для пациентов с ТТП характерна выраженная тромбоцитопения, обычно 10-30 х 109/л.
2) Биохимический анализ крови. При ТТП выявляются:
повышение ЛДГ;
изменения мочевины, креатинина, электролитов (при поражении почек);
трансаминазы – в пределах нормы;
повышение непрямого билирубина (гемолиз)
3) Общий анализ мочи (гемолиз, потеря белка)
4) Антиглобулиновый тест (прямая проба Кумбса) для уточнения характера анемии. Отрицательная прямая проба Кумбса свидетельствует о неиммунном характере анемии.
5) Гаптоглобин в крови для уточнения характера анемии.
6) Протромбиновое (тромбопластиновое) времени и исследование концентрации фибриногена в плазме крови для уточнения состояния свертывающей системы
7) Исследование концентрации тропонинов I, T в крови для диагностики поражения сердца (повышены более чем в 50% случаев острой иммуноопосредованной ТТП)
8) Определение активности металлопротеиназы ADAMTS-13 в плазме крови для подтверждения диагноза ТТП.
Диагноз ТТП подтверждается при
активности ADAMTS13 в плазме менее 10%. Образцы плазмы на исследование
активности ADAMTS13 должны быть взяты до начала трансфузий плазмы либо
плазмообмена. Значительно повышает достоверность диагностики определение
функциональной активности ADAMTS-13 иммунофлуоресцентным методом.
8) Содержание антител к металлопротеиназе ADAMTS-13 в плазме крови.
В образцах с низкой активностью ADAMTS-13 имеет смысл определить антитела к данной ADAMTS-13 для диагностики приобретенной иммуноопосредованной формы заболевания.
9) Молекулярно-генетическое исследование (экзоны 5, 6, 20, 24, 29 гена ADAMTS13). При подозрении на врождённую форму необходимо тестирование на наличие патогенных вариантов в гене ADAMTS13. Обычно анализируются экзоны 5, 6, 20, 24, 29 гена ADAMTS13.
10) Тест на беременность (пациенткам пубертатного возраста с подозрением на ТТП). Беременность может быть фактором, провоцирующим ТТП.
11) Исследование на вирусы гепатита А, В, С и ВИЧ (выявление возможных провоцирующих факторов).
12) Скрининг болезней соединительной ткани (выявление возможных провоцирующих факторов).
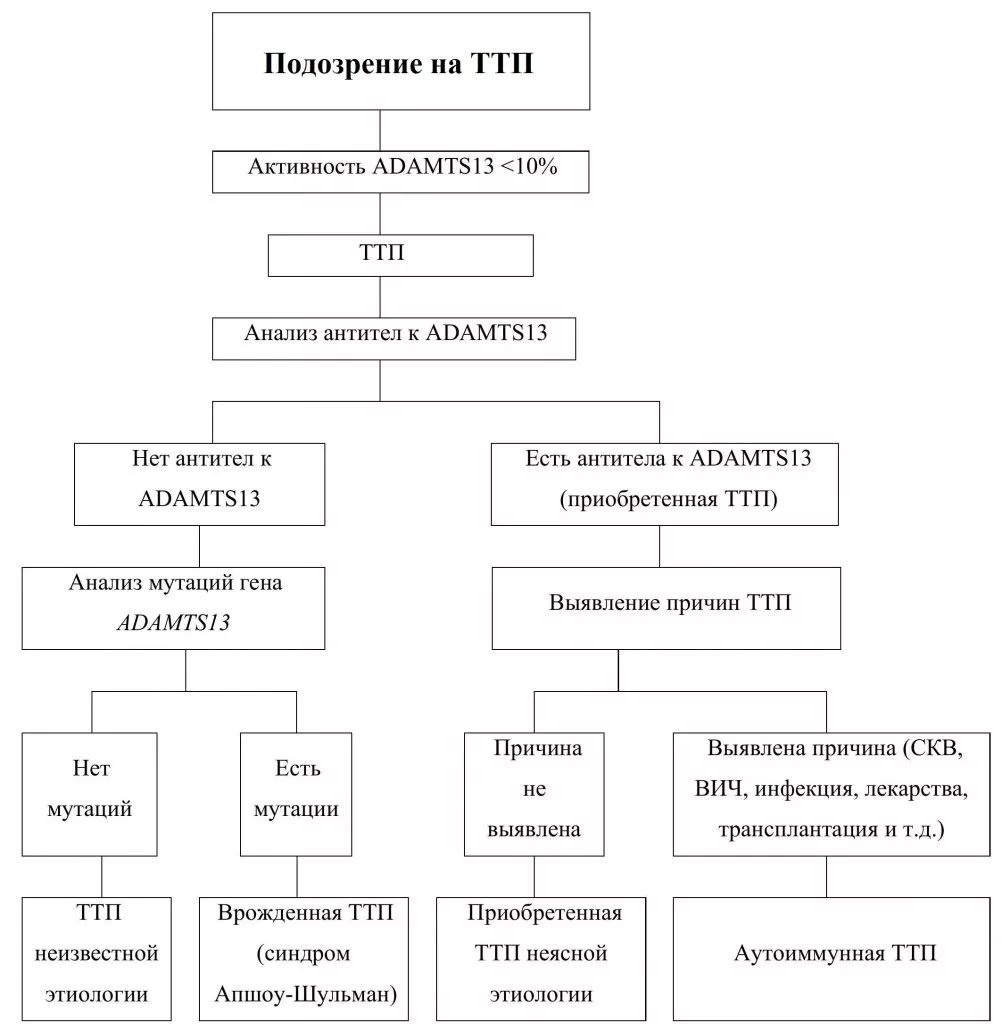
Рис 3. Алгоритм диагностики тромботической тромбоцитопенической пурпуры. Развернуть на всю страницу.
1) Гемолитико-уремический синдром. Клинические рекомендации МЗ РФ. 2021 г.
2) Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома. Научное общество нефрологов России. 2014 г.
3) Атипичный гемолитико-уремический синдром. Клинические рекомендации МЗ РФ. 2021 г.
4) Тромботическая тромбоцитопеническая пурпура. Проект клинических рекомендаций.
5) Scully M, Rayment R, Clark A et al. A British Society for Haematology Guideline: Diagnosis and management of thrombotic thrombocytopenic purpura and thrombotic microangiopathies. Br J Haematol. 2023 Nov;203(4):546-563. doi: 10.1111/bjh.19026
6) Галстян Г.М., Клебанова Е.Е. Диагностика тромботической тромбоцитопенической пурпуры // Терапевтический архив. - 2020. - Т. 92. - №12. - C. 207-217.
7) Robert Schneidewend, Narendranath Epperla, Kenneth D. Friedman, Chapter 134 - Thrombotic Thrombocytopenic Purpura and the Hemolytic Uremic Syndromes, Editor(s): Ronald Hoffman, Edward J. Benz, Leslie E. Silberstein, Helen E. Heslop, Jeffrey I. Weitz, John Anastasi, Mohamed E. Salama, Syed Ali Abutalib, Hematology (Seventh Edition), Elsevier, 2018, Pages 1984-2000, ISBN 9780323357623, https://doi.org/10.1016/B978-0-323-35762-3.00134-7 .